ТЕМПЕРАТУРНЫЙ ФАКТОР В СХВАТЫВАНИИ ЦЕМЕНТНЫХ РАСТВОРОВ И НАБОРЕ ПРОЧНОСТИ
ТЕМПЕРАТУРНЫЙ ФАКТОР В СХВАТЫВАНИИ ЦЕМЕНТНЫХ РАСТВОРОВ И НАБОРЕ ПРОЧНОСТИ
|
|
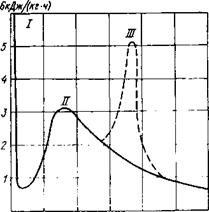
Рассмотрим типичную форму кривой изменения скорости тепловыделения на рис. 5.1. Сразу после затворения цемента водой начинается бурное выделение тепла, которое отмечается пиком I. Затем следует падение скорости тепловыделения до минимума. Длительность первого периода обычно составляет несколько минут. Резкое увеличение тепловыделения (пик II) часто объясняют возрастанием скорости гидратации’трех-
Рис. 5.1. Изменение скорости тепловыделения во времени.
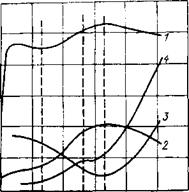
Рис. 5.2. Качественный характер изменения концентрации СаО (/), тепловыделения (2), электросопротивления (3), пластической прочности цементного теста во времени (4).
|
|
НС и КС — начало-и конец схватывания раствора; ИКС — истинный конец схватывания.
кальциевого алюмината СзА или интенсивной гидратацией поверхностного слоя цементных частиц. Иногда наличие первого пика связывают с тепловым эффектом смачивания [Запорожец И. Д., 1963 г.].
В дальнейшем мощность внутренних источников тепла начинает расти и через определенное время достигает максимума. Установлено, что момент максимального тепловыделения соответствует концу схватывания цементного раствора. На рис. 5.2 представлены данные [Ахвердов И. Н., 1963 г.], согласно которым в момент схватывания другие показатели цементного раствора также имеют характерные точки: электросопротивление имеет минимальное значение, а содержание свободного оксида кальция в жидкости затворения максимальное. После достижения максимального значения скорость тепловыделения начинает плавно снижаться и асимптотически приближается к нулю.
Иногда наблюдается другой максимум тепловыделения (пик III), происхождение которого можно объяснить наличием в системе некоторого количества (СзА, не образовавшего сульфоалюминат из-за недостатка гипса. Вновь возникающая гидратация СзА сопровождается его гидролизом с выделением новых порций СаО, которые вступают в реакцию с водой. Поскольку гашение СаО является экзотермическим процессом, то тепловыделение увеличивается. Однако при достаточном содержании гипса в цементе это явление не наблюдается [Ли Ф., 1961 г.].
Таким образом, изменение скорости экзотермии во времени удобно разделить на два периода: от момента затворения до конца схватывания цементного раствора, а также период истинного твердения — после конца схватывания. В практике крепления скважин оба периода имеют важное значение. Однако влияние температуры на процесс тепловыделения и гидратации оказывается различным. В течение первого периода, когда протекает гидратация цементного раствора, процесс является неупорядоченным и многократно обратимым. Поэтому влияние температуры на скорость гидратации и сроки схватывания предсказать зачастую довольно трудно [Ли Ф., 1961 г.]. Обычно сроки схватывания портландцемента уменьшаются при повышении температуры, но величина этих изменений колеблется у разных цементов. Так, два цемента, имеющие равные
|
Таблица 5.2 Время схватывания водных растворов портландцемента, ч
|
сроки схватывания при 16°С, могут иметь различные сроки при 3°С. Иллюстрацией сказанного служат данные табл. 5.2. Влияние температуры на срок схватывания (конец) более заметно. За исключением цемента 7 конец схватывания наступает быстрее при высокой температуре.
Влияние температуры на сроки схватывания водного раствора тампонажного цемента выражено более заметно. Так, в одной из ранних работ [Горский А. Т., 1968 г.] выполнено исследование растворов и камня с цементом Стерлитамакского завода при температурах от 20 до 0°С — Установлено, что с понижением температуры сроки схватывания цементных растворов значительно возрастают, особенно в интервале от 10 до 0°С: сроки схватывания в 2—4 раза больше, чем при температуре 20°С. Так, например, при 0°С начало схватывания наступало через 34, а конец через 48 ч. В целом аналогичная картина наблюдалась для такого показателя, как прочность цементного камня на изгиб: с понижением температуры темп нарастания прочности значительно снижается, что особенно характерно для ранних сроков твердения. Экспериментальные результаты приведены в табл. 5.1. Так, например, прочность на изгиб цементного камня при 0°С в 40 раз ниже, чем при температуре 20°С. Как следует из данных табл. 5.1, при температуре 0°С только через 2 сут после приготовления цементного раствора начинается образование камня.
Результаты исследования экзотермии цемента при пониженных положительных и отрицательных температурах опубликованы в работе [4]. Методика опытов заключалась в следующем. Цементный раствор с определенной исходной температурой заливался в цилиндр, который помещался в сосуд Дьюара. В свою очередь сосуд Дьюара опускали в термо — статирующую жидкость, температура которой поддерживалась постоянной и равной исходной температуре цементного раствора. В дальнейшем фиксировалось изменение температуры цементного раствора в течение 100 ч. По температурной кривой выполнялся расчет экзотермии с учетом потерь тепла в окружающую среду. Экспериментальные данные приведены в табл. 5.3. Анализ полученных результатов показывает, что снижение начальной температуры цементного’раствора приводит к уменьшению тепловыделения в первые трое суток после начала процесса. Однако результаты табл. 5.3 нельзя использовать для практических расчетов, так как в условиях скважины температура цементного раствора будет подчиняться иной закономерности.
Наиболее интересные и достоверные данные получены в работе [5], поскольку процесс протекал в изотермических условиях. Здесь было иссле-
|
81 |
6 Заказ 1935
|
Экзотермия водных растворов портландцемента [4|
|
довано влияние хлористого кальция на тепловыделение, т. е. на процесс, являющийся прямой функцией гидратации. Полученные результаты представляют интерес для оценки гидратации цемента и производства термодинамических расчетов. Было исследовано влияние добавок хлористого кальция (в количестве 2,4 и 6% к воде затворения) на тепловыделение при твердении раствора из низкогигроскопичного тампонажного цемента (минералогический состав, %: СзБ 63,2; р = C2S 13,2; СзА 7,2; C4AF 13,5; SO3 2,6; ТЭА 0,025) при температуре —5°С. Водоцементное отношение составляло 0,5.
Использовался автоматический калориметр НИИЖБ. Датчиками температуры в установке служили хромель-копелевые термопары. В качестве вторичного прибора использовали самопишущий электронный потенциометр КСП-4, отградуированный на невысокие положительные и отрицательные температуры. Термостатирование осуществляли с применением циркулирующего водного раствора глицерина в термостате ТС-16А. Раствор глицерина охлаждался до нужной температуры в холодильной приставке. Для получения цементного раствора с отрицательной темпера; турой (—5°С) цемент к моменту затворения предварительно выдерживали при температуре —10°С, а жидкость затворения при 1°С.
Анализ графиков, характеризующих тепловыделение и скорость тепловыделения, позволил выделить четыре периода гидратации, аналогичных периодам гидратации при нормальной и повышенной температурах. В первый период происходит интенсивная гидратация поверхностного I слоя цементных,, частиц с выделением тепла. Скорость тепловыделения в этот кратковременный период наибольшая. В течение второго периода скорость тепловыделения резко снижается. Третьему периоду при использовании цементных растворов с добавками хлористого кальция соответствует бурное выделение тепла, однако скорость тепловыделения при этом ниже, чем в первый период. Выделение тепла в течение третьего периода происходит за счет гидратации алита — основного минерала портланд — цементного клинкера. Для четвертого периода характерно снижение скорости тепловыделения вследствие того, что основная масса алита уже прореагировала. Дальнейшее незначительное выделение тепла происходит за счет гидратации белита.
Проведенные исследования показали, что увеличение добавки хлористого кальция до 6% приводит к сокращению второго периода и повы-
|
Экзотермия водных растворов портландцемента при температуре —5°С
|
шению интенсивности тепловыделения в течение первого и третьего периодов.
Таким образом, при отрицательной температуре увеличение добавки хлористого кальция в рассмотренных концентрациях приводит к интенсификации тепловыделения при гидратации цемента. Без добавки ускорителя твердения скорость тепловыделения резко снижается, что может привести к частичному замерзанию жидкой фазы цементного раствора, причем образующиеся кристаллы льда могут вызвать деструкцию цементного камня. Экспериментальные результаты помещены в табл. 5.4.
Практический интерес представляет прогноз влияния температуры на тепловыделение и прочность цементного камня, поэтому остановимся на результатах работы [54]. При исследовании кинетических закономерностей превращения вяжущих в продукты реакции, необходимо знать константу скорости реакции. Для ее определения обычно используют известное уравнение Аррениуса
К = Аехр[—E/(RT)], (5.7)
где К — константа скорости реакции; А — предэкспоненциальный множитель; R — универсальная газовая постоянная; Е — энергия активации; Т — абсолютная температура.
Из формулы (5.7) следует, что константа скорости реакции в существенной степени зависит от энергии активации. Однако в вопросе о численных значениях энергии активации существуют противоречивые мнения. Так, например, согласно результатам одних исследований гидратация основных минералов цемента СзБ и P-C2S представляет собой реакцию с энергией активации 8,8 и 7,7 кДж/моль соответственно. Вместе с тем, для гидратации тех же минералов известны другие значения, составляющие 75,7 и 42 кДж/моль [24]. В работах [24, 68] приведены значения энергии активации гидратации полиминерального цемента, равные 32,3 и 37,8 кДж/моль.
Авторы работы [30] подвергают сомнению истинный смысл энергии активации. Согласно их мнению, рост скорости гидратации зависит
|
0,200,15 0,10 — 0,05 0 |
|
4.2 5,4 2.6 %8 |
. aAm
AG,-TAS;E;AH, кДж/маль ‘AS>—g 100 *“*T
|
30 |
|
45 60 75Т, Т |
Рис. 5.3. Зависимость термодинамических параметров гидратации цементного камня от температуры.
от увеличения размера и объема пор в связи с ростом кристаллов продуктов реакции при увеличении температуры выдержки.
Ниже приводится обоснование численных значений, а также температурной зависимости энергии активации реакции гидратации цемента. Согласно работе [68] множитель Л в формуле (5.7) представим в форме
|
(5.8) |
А — ехр(0,5Г+В),
где В для данных реагирующих веществ — величина постоянная.
Из формул (5.7) и (5.8) найдем выражение для средней энергии активации
|
(5.9) |
в TJ2R, ( К2 ,/17 Tj—7"| К Тг )’
Для определения Е были использованы результаты экспериментальных исследований тепловыделения цемента [20], который имел следующий усредненный состав, %: C3S 54,4; p-C2S 24,4; С3А 3,7; C4AF 17,5. Изменение свободной энергии цемента в процессе реакции гидратации представим в виде
|
(5.10) |
AG = АН — TAS,
где АН и AS — изменение энтальпии и энтропии.
Согласно работе [68] энтальпию реакции можно выразить через экспериментально найденное значение энергии активации
|
(5.11) |
АН — Е — RT.
Энергию AG определяем по методике работы [68]. Зная AG и АН, из (5.10) находим энтропию
|
(5.12) |
AS = —(AG—AH)/T.
Закономерности изменения AG, АН, Е, —ТАЗ и AS в зависимости от температуры представлены на рис. 5.3. Отсюда следует, что при 22°С величины ЛЯ и —TAS равны между собой. Значение энтропии реакции выше 22°С практически не изменяется и ее численное значение соответствует энтропии наиболее устойчивых гидратных новообразований [24]. Это подтверждает, что выше 22°С скорость реакции гидратации лимитируется скоростью поступления в зону реакции воды, тогда как при более низких температурах кинетика процесса лимитируется скоростью химических реакций.
На рис. 5.3 также представлены зависимости Е, АН и вязкости воды б от температуры. Отсюда следует, что закономерность изменения относительного значения энтальпии и вязкости совпадают. Этот факт можно объяснить тем, что наряду с процессом химического превращения все гетерогенные реакции характеризуются процессами переноса, необходимыми для восполнения расхода реагирующих веществ, а также удаления продуктов реакции [19]. В работе ]9] показано, что скорость переноса вещества, а значит, и количество химически связанной воды обратно пропорционально вязкости воды. С другой стороны, известно, что с небольшой погрешностью изменение энтальпии вяжущего прямо пропорционально количеству химически связанной воды или, другими словами, также обратно пропорционально вязкости [24]. Эксперименты [24] показывают, что отношение энтальпии единицы массы вяжущего к количеству химически связанной воды в диапазоне 5—100°С остается постоянным. Таким образом, в относительных координатах изменение энтальпии цемента и вязкости воды в зависимости от температуры должно совпадать, что и подтверждают представленные на рис. 5.3 результаты.
В реакции гидратации портландцемента энтальпия и энергия активации в связи с малостью произведения RT в формуле (5.11) различаются незначительно. Поэтому с небольшим приближением можно принять, что изменение энергии активации реакции гидратации в зависимости от температуры также пропорционально изменению вязкости воды. Полученный результат противоречит изложенному выше мнению [30] и указывает на то, что рост скорости гидратации цемента при увеличении температуры выдержки объясняется снижением вязкости воды. Мнение авторов работы [30] также опровергают экспериментальные данные [24], которые указывают на неизменность химической и физической природы продуктов реакции в исследованном диапазоне температур от 5 до 100°С.
Таким образом, представленные на рис. 5.3 результаты показывают, что численное значение энергии активации реакции гидратации цемента данного химического состава при изменении температуры не остается постоянным, а изменяется от 93 до 20 кДж/моль, т. е. в довольно широких пределах. Если цемент будет иметь иной химический состав, то энергия активации может существенно измениться, однако ее численные значения нетрудно найти. Для этого следует определить AG при 0°С по методике работы [68], а температурную зависимость энергии активации можно найти, воспользовавшись полученными выше результатами.