 ОСНОВНЫЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ
ОСНОВНЫЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ
Из всех дисперсных систем наиболее полно отвечают требованиям, предъявляемым к промывочным жидкостям, коллоидные системы. Своеобразие физико-химических свойств коллоидных систем (или коллоидных растворов) определяется их развитой поверхностью раздела на границе твердая фаза — дисперсионная среда.
По молекулярно-кинетической теории внутреннее сцепление тел обусловлено силами взаимодействия молекул. Внутри тела, например жидкости, эти силы уравновешены: каждая молекула притягивает к себе соседние с такой же силой, с какой сама к ним притягивается. Силы же притяжения поверхностных молекул, например расположенных на поверхности раздела жидкость— воздух, не уравновешены (рис. 1). В результате избытка сил притяжения со стороны жидкости молекулы с границы раздела стремятся втянуться внутрь жидкости, поэтому поверхность раздела стремится к уменьшению.
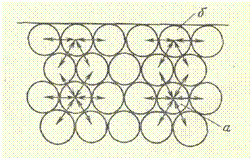


Рис. 1. Схема действия молекулярных сил:
A — на молекулу, находящуюся внутри жидкости; б — на молекулу, расположенную в поверхностном слое.
Аналогичное явление происходит в любых дисперсных системах. В связи с этим поверхностные молекулы на разделе фаз обладают некоторой некомпенсированной избыточной энергией, называемой поверхностной энергией. Некомпенсированность молекулярных сил в поверхностном слое жидкостей и твердых тел определяет все виды их молекулярного взаимодействия.
Избыточная поверхностная энергия, приходящаяся на 1 м2 поверхности, т. е. удельная поверхностная энергия, представляет поверхностное (межфазное) натяжение на границе раздела фаз.
Поверхностное натяжение σ Можно представить как работу образования 1 м2 поверхности, а также как силу, отнесенную к единице длины контура, ограничивающего поверхность жидкости, и действующую в плоскости, касательной к этой поверхности в сторону ее сокращения. Поэтому поверхностное натяжение измеряется в Дж/м2 или Н/м.
С повышением температуры поверхностное натяжение уменьшается. Поверхностная энергия может изменяться вследствие изменения удельной поверхности и поверхностного натяжения.
Из происходящих на поверхностях раздела фаз явлений, связанных с некомпенсированной поверхностной энергией, важное значение для промывочных жидкостей имеет адсорбция— самопроизвольное повышение концентрации растворенного вещества на границе раздела фаз по сравнению с концентрацией этого вещества во всем объеме дисперсной системы.
Вещество, на поверхности которого адсорбируются и удерживаются молекулы другого вещества, называется адсорбентом, а вещество, которое удерживается на поверхности адсорбента,— адсорбтивом. Находящийся в дисперсионной среде адсорбтив в результате диффузии стремится равномерно распределиться в объеме жидкости. При этом отдельные молекулы растворенного вещества сталкиваются с поверхностью твердой фазы, и, испытывая с ее стороны большое притяжение, адсорбируются на ней. Оставшееся в жидкости растворенное вещество снова равномерно распределяется в объеме дисперсионной среды. Происходит накопление вещества на поверхности адсорбента.
Некоторые молекулы недостаточно прочно удерживаются поверхностью твердого тела и отрываются от него, происходит явление десорбции. Так происходит до тех пор, пока поверхность адсорбента насытится адсорбтивом и между адсорбцией и десорбцией наступит динамическое равновесие. Чем выше концентрация адсорбтива, тем выше адсорбция.
При адсорбции молекулы адсорбтива и среды являются конкурентами. Следовательно, чем хуже адсорбируется среда на адсорбенте, тем лучше будет происходить адсорбция растворенного вещества на поверхности твердого тела. В первом приближении можно считать, что чем выше поверхностное натяжение чистой среды, тем меньше способность ее молекул к адсорбции на твердом теле и тем лучше на ней будет адсорбироваться растворенное вещество.
Измеряется адсорбция количеством вещества в молях, адсорбировавшегося на 1 см2 поверхности, или количеством адсорбировавшегося вещества на 1 г адсорбента. Адсорбция сопровождается выделением тепла. Она вызывает изменение поверхностного натяжения. Установлено, что в коллоидных системах различные растворенные вещества по-разному действуют на поверхностное натяжение.
Вещества, понижающие поверхностное натяжение, называются поверхностно-активными (ПАВ). Они играют большую роль в формировании свойств промывочных жидкостей и тампонажных смесей.
В ряде случаев физический процесс адсорбции сопровождается химическим взаимодействием веществ — хемосорбцией, которая обычно необратима.
Частицы дисперсной фазы в коллоидных системах в результате отчасти адсорбции, а отчасти прямого перехода ионов одной фазы дисперсной системы в другую заряжаются электричеством. Вследствие этого под воздействием разности потенциалов электрического поля в коллоидных системах возникает ряд электрокинетических явлений.
Если приложить разность потенциалов к двум точкам внутри какого-либо объема дисперсной системы, то между этими точками возникнет движение коллоидных частиц и дисперсионной среды. Отрицательно заряженные частицы будут перемещаться к положительному полюсу, а положительно заряженные — к отрицательному. Происходит явление электрофореза.
Когда пространство между электродами разделено перегородкой, проницаемой для среды и непроницаемой для частиц, под действием электрического тока среда будет перемещаться в направлении одного из электродов, в то время как дисперсные частицы будут скапливаться и давить на перегородку с противоположной стороны. Это явление получило название электроосмоса. Электрофорез и электроосмос играют большую роль в усилении закрепляющего действия на стенки скважин некоторых промывочных жидкостей и тампонажных смесей.
Большое значение в характеристике дисперсных систем (особенно коллоидных) имеет интенсивность молекулярного взаимодействия между дисперсионной средой и дисперсной фазой на границе раздела фаз, что определяет явление смачиваемости. Смачивание жидкостью твердого тела можно рассматривать как результат действия сил поверхностного натяжения. По интенсивности граничных молекулярных взаимодействий коллоидные дисперсные системы делятся на лиофильные и лио-фобные. Если дисперсионной средой является вода, системы соответственно называются гидрофильными и гидрофобными.
Гидрофильные коллоидные системы Характеризуются относительной устойчивостью — стабильностью во времени. Частицы дисперсной фазы системы прочно связывают молекулы растворителя и также прочно их удерживают, т. е. гидрофильным коллоидным системам свойственно высокоинтенсивное молекулярное взаимодействие между частицами дисперсной фазы и дисперсионной средой.
Частицы твердой фазы, например глины, в гидрофильной коллоидной системе сравнительно легко диспергируются, т. е. распадаются на элементарные частицы. В результате нарушения молекулярных связей поверхность частицы дисперсной фазы оказывается заряженной отрицательно. Молекулы воды, являясь диполями, притягиваются своими положительно заряженными концами к отрицательно заряженной поверхности твердой частицы. Эта вода прочно связана с поверхностью частицы, обладает повышенной плотностью и вязкостью и не отделяется от нее даже при центрифугировании, создающем усилия, в тысячу раз превышающие силу тяжести. Так как электромолекулярные силы действуют на весьма небольшом расстоянии, толщина пленки не превышает 6•10-6 мм.
Молекулы связанной или адсорбированной воды, составляющие так называемую граничную фазу, оказывают притягивающее и ориентирующее влияние на окружающие молекулы и ионы, в результате чего образуется диффузная оболочка (рис. 2). В пределах последней находятся отщепленные от твердой частицы и окруженные диполями воды катионы, образующие ионные «облака». В отличие от адсорбированной воды граничной фазы воду в пределах диффузной оболочки называют лиосорбированной.
Вода в дисперсной системе, не связанная молекулярными силами взаимодействия с твердой поверхностью, называется свободной водой. Чем интенсивнее диспергирована твердая фаза, тем относительно большее количество связанной воды в системе. Величина диффузного слоя зависит от концентрации солей (электролитов), всегда в каком-то количестве находящихся в дисперсионной среде. Если концентрация электролитов мала, то диффузный слой достигает значительной величины. С ростом концентрации электролитов диффузный слой сжимается, приближаясь к границам адсорбционного слоя (граничной фазы). Электрический заряд поверхности твердой частицы погашается как в слое связанной (адсорбированной) воды, так и в диффузном слое. Отрицательно заряженная поверхность частицы и катионы в диффузной оболочке совместно образуют двойной электрический слой. Падение напряжения на всем интервале между твердой поверхностью частицы и свободной водой называется термодинамическим потенциалом, а на участке диффузной оболочки — электрокинетическим потенциалом или z-потенциалом. Интенсивность электромолекулярного взаимодействия фаз в коллоидном растворе характеризуется величиной термодинамического потенциала которая зависит от общего числа адсорбированных частицей ионов.
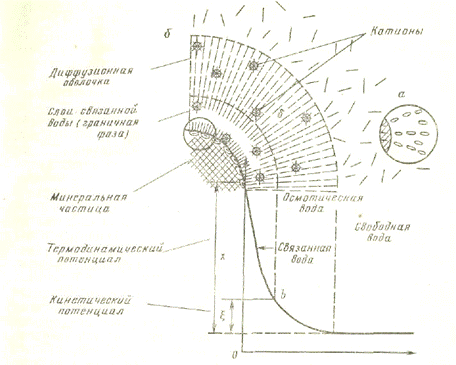
Рис. 2. Схема молекулярного взаимодействия сил в системе твердая частица — вода:
А — ориентация диполей воды поверхностью твёрдой частицы; Б — схема связанности воды в литосфере; — эпюра изменения молекулярных сил в зависимости от расстояния до поверхности минеральной частицы
Адсорбированный и диффузный слои образуют вокруг твердой частицы гидратную оболочку, которая препятствует слипанию частиц между собой. В общем случае дисперсионной средой может быть и не вода. Тогда оболочка вокруг твердой частицы называется сольватной. Частица дисперсной фазы с оболочкой получила название мицеллы.
Гидратная оболочка развита неравномерно. Наибольшая ее толщина по плоским поверхностям частицы, наименьшая — на острых гранях и углах.. Гидратные оболочки характеризуют стабильность дисперсной системы, они предохраняют частицы твердой фазы от агрегирования и выпадения из раствора.
Гидрофобные коллоидные системы Характеризуются слабым молекулярным взаимодействием частиц дисперсной фазы с дисперсионной средой. Частица дисперсной фазы не имеет сродства с растворителем (не обволакивается прочной гидратной оболоч —
Кой), поэтому гидрофобные дисперсные системы неустойчивы. Они могут быть стабилизированы путем создания на частицах дисперсной фазы адсорбционных слоев некоторых поверхностно-активных веществ. Такие вещества получили название стабилизаторов.
Адсорбция ПАВ — стабилизатора вызывает изменение свойств поверхности раздела фаз, усиление интенсивности молекулярного взаимодействия между дисперсной фазой и дисперсионной средой. Мицелла стабилизированной гидрофобной системы представляет собой элементарную частицу, состоящую из частицы дисперсной фазы, адсорбционного слоя стабилизатора и многослойной гидратной оболочки с ориентированными молекулами дисперсионной среды.
Гидрофобные коллоидные системы стабилизируют и добавками к ним некоторых гидрофильных коллоидов, получивших название защитных. Механизм защитного действия сводится к образованию вокруг коллоидной частицы адсорбционной оболочки из высокомолекулярного вещества. Защитное действие гидрофильные коллоиды могут оказывать и на грубодисперсные системы — суспензии.
Стабилизированные гидрофобные дисперсные системы объединяют большую группу промывочных жидкостей, дисперсная фаза которых представлена продуктами разрушения горных пород. Наряду с адсорбцией на поверхности частиц твердой фазы, главным образом глинистых, происходят следующие явления: 1) ионный обмен (реакции замещения), когда в кристаллической решетке минерала катионы замещаются катионами дисперсионной среды, 2) необменные замещения органических и неорганических катионов и целых групп; 3) присоединения, когда образуются новые химические соединения. Все эти процессы происходят одновременно, взаимно накладываясь. Они определяют механизмы ингибирования (снижения гидрофильности), стабилизации и коллоидной защиты в промывочных жидкостях— дисперсных системах. Интенсивность всех явлений на поверхности частичек твердой фазы возрастает с ростом дисперсности.
Эффективность применения промывочных жидкостей и тампонажных смесей как дисперсных коллоидных систем связана с их устойчивостью. Различают кинетическую (седиментационную), агрегативную и термодинамическую устойчивости.
Кинетическая устойчивость дисперсных систем обеспечивается двумя противоположными процессами — оседанием частиц под действием силы тяжести и броуновским движением, при котором частицы равномерно распределяются по объему. Чем выше степень дисперсности и температура, тем более кинетически устойчива такая система.
Агрегативная устойчивость определяет способность частиц дисперсной фазы не слипаться. Она является результатом действия между коллоидными частицами двух противоположно направленных сил. С одной стороны действуют силы притяжения, под влиянием которых частицы слипаются, с другой стороны проявляются силы отталкивания, препятствующие сближению частиц и их соединению. Силы притяжения носят характер молекулярного взаимодействия (ван-дер-ваальсовых сил). Силы отталкивания определяются электрическим взаимодействием между ионами двойных электрических слоев, окружающих каждую частицу. Результирующая этих двух сил и обусловливает большую или меньшую агрегативную устойчивость коллоидной системы. Таким образом, агрегативная устойчивость дисперсных систем определяется наличием, величиной и характером распределения гидратных оболочек на частицах твердой фазы.
Агрегативная устойчивость может быть также обеспечена наличием на частицах дисперсной фазы адсорбционного слоя поверхностно-активного вещества, препятствующего слипанию частиц при сталкивании.
Термодинамическую устойчивость предопределяет наличие поверхностей раздела в дисперсных системах. Дисперсные промывочные жидкости и тампонажные растворы вследствие сильно развитой межфазной поверхности агрегатив-но неустойчивы и стремятся к равновесному состоянию с минимумом свободной энергии. Это практически приводит к разделению системы на две сплошные фазы. Устойчивость таких систем тем меньше, чем больше запас энергии на межфазной поверхности. При наличии в системе стабилизаторов, способных адсорбироваться и понижать межфазное натяжение, свободная энергия уменьшается, а устойчивость системы возрастает.
По агрегативному состоянию и механическим свойствам дисперсные системы делятся на две группы: свободно-дисперсные (или бесструктурные) и связно-дисперсные (или структурированные).
Свободно-дисперсные системы отличаются подвижностью и не оказывают сопротивления сдвигу. Связно-дисперсная система, получившая название геля, отличается наличием сплошной пространственной структуры. Связно-дисперсная система обладает вязкостью, пластичностью, прочностью, упругостью и рядом других физико-механических характеристик, зависящих от свойств компонентов, ее составляющих, и их количественного соотношения.
Для получения структуры в дисперсной системе наряду с Другими условиями требуется определенная концентрация твердой дисперсной фазы. Последняя зависит при прочих равных условиях от формы частиц дисперсной фазы. Наиболее благоприятной для образования структуры дисперсной системы является анизодиаметрическая форма частиц.
Пространственная структура связно-дисперсных систем при механическом воздействии (перемешивании) разрушается. Гель переходит в золь. В состоянии покоя структура восстанавливается. Золь переходит в гель. Процесс, связанный с созданием и разрушением пространственной структуры, получил название тиксотропии. Тиксотропия — изотермический процесс.
Многочисленными опытами установлено, что тиксотропию дисперсных систем обеспечивают следующие факторы: 1) достаточно большое число частиц дисперсной фазы, что облегчает построение пространственной структуры; 2) наличие коллоидной фракции частиц дисперсной фазы, играющей роль клея для грубодисперсных частиц; 3) не слишком высокая прочность структуры и ее способность к остаточным деформациям.
Тиксотропность — одна из важнейших характеристик промывочных жидкостей.
Из процессов, протекающих в дисперсных системах и характеризующих устойчивость систем, следует назвать коагуляцию— укрупнение (слипание, слияние) частиц дисперсной фазы под действием молекулярных сил сцепления или сил тяжести. Образование геля обусловлено явлением коагуляции. Различают коагуляцию гидрофильную и гидрофобную. К образованию пространственной структуры дисперсной системы приводит гидрофильная коагуляция. Гидрофобная коагуляция характеризуется полным расслоением дисперсной системы на твердую и жидкую фазы, причем частицы твердой фазы, лишенные гидрат-ных оболочек, соединяясь, образуют хлопья, которые выпадают в довольно плотный осадок. Слипание гидрофобных минеральных частиц в хлопья называют флокуляцией.
По характеру связей между отдельными элементами все структуры делятся на обратимые — коагуляционно-тиксотропные и необратимые — конденсационно-кристаллизационные. Первые обладают низкой прочностью и легко восстанавливаются во времени под действием ван-дер-ваальсовых сил. Вторые обусловлены прочными химическими связями при непосредственном сцеплении частиц и разрушаются необратимо. Эти структуры характерны для большинства твердеющих тампонажных растворов.
Коагуляция вызывается различными причинами: старением, изменением концентрации дисперсной системы, температуры, механических воздействий, введением различных веществ. В разведочном бурении наибольшее значение имеет коагуляция, возникающая при поступлении в промывочную жидкость электролитов. При этом концентрация их в системе должна быть достаточной для сжатия двойного электрического слоя и понижения энергетического барьера, препятствующего слипанию частиц при их столкновении. Минимальная концентрация электролита, при повышении которой начинается коагуляция, называется порогом коагуляции.
Процесс коагуляции дисперсных систем делится на скрытую и явную стадии. При скрытой коагуляции частицы постепенно теряют свою устойчивость, невооруженным глазом это явление не обнаруживается. Явная коагуляция характеризуется слипанием и агрегированием частиц под действием молекулярных сил притяжения вплоть до выпадения в осадок.
Дисперсность скоагулированной коллоидной системы можно восстановить, добавляя специальные адсорбирующие вещества — пептизаторы. Процесс восстановления дисперсности в этом случае носит название пептизации. При этом повышается заряд частиц твердой фазы и происходит их диспергирование за счет электростатического отталкивания (ионные пептизаторы). Другие пептизаторы, сольватируя частицы, расклинивают их по трещинам на более мелкие. Пептизатор, адсорбируясь на поверхности частиц дисперсной фазы, действует как стабилизатор. Вновь образовавшиеся на поверхности частиц твердой фазы адсорбционно-гидратные оболочки и пространственные двойные электрические слои начинают препятствовать сближению твердых частиц.
Охлаждение дисперсных систем затормаживает развитие процессов, способствующих пептизации и диспергированию. Очень сильное охлаждение, сопровождающееся замораживанием, часто приводит к коагуляции. Причиной ее при замораживании является разрушение гидратной оболочки. При умеренном охлаждении и достаточно высоком содержании минеральных солей в жидкой фазе замораживания и коагуляции не происходит и дисперсная система нормально выполняет свои функции.