 ГЛИНЫ
ГЛИНЫ
Природа глин, их структура и химический состав
Глины — главная, наиболее активная часть глинистых растворов, поэтому свойства последних во многом определяются свойствами исходных глин.
Глины — широко распространенные осадочные горные породы, представляющие собой смесь различных минералов, главным образом глинистых. Наиболее важными свойствами глин являются набухаемость, пластичность, гидрофильность, ионный обмен и способность диспергироваться в воде на мельчайшие частички.
Глины образуются в процессах химического выветривания за счет разложения магматических и других пород. Глинистые минералы отличаются тонкодисперсностью. Существует ряд глинистых минералов, которые классифицируются либо по химическому составу, либо по особенности кристаллического строения. К основным породообразующим минералам глинистых пород, используемых для растворов, относятся минералы групп монтмориллонита, гидрослюд, палыгорскита и каолинита.
Очень редко глина имеет мономинеральный состав. Как правило, она содержит несколько глинистых минералов. В таком случае глина получает название по наименованию преобладающего минерала. Исключение составляют бентонитовые глины, основной минерал которых — монтмориллонит.
В химическом отношении глины представляют собой гидратированные алюмосиликаты. Химический состав основных глинистых минералов выглядит следующим образом:
Монтмориллонит (OH)4•Al4Si8020•nH20;
Иллит (гидрослюда) (OH)4Ky(Al4•Fe4•Mg6) (Si8yAly)O20 • nН2О;
Палыгорскит (OH)2•Si8•Mg5•O18•4H2O;
Каолин (OH)8Si4Al4O10•nH20.
В глинах, кроме того, содержатся в различных количествах окислы железа (например, Fe2O3), щелочных металлов (Na2O; К2О), щелочноземельных металлов (CaO; MgO). Окислы металлов связаны с глинистыми минералами различно. Часть их может входить в состав глинистых минералов, замещая окислы алюминия, часть же их связана с глинистым веществом слабее и представляет собой обменные основания.
Один из определяющих признаков глинистых минералов — отношение SiO2:R2O3 (где R —A1 или Fe). Это отношение колеблется от двух для минералов каолиновой группы до четырех и более для минералов монтмориллонитовой группы.
Кристаллические решетки глинистых минералов состоят в основном из двух структурных единиц — глинозема и гидрата кремнезема. Глинозем представляет собой два плотно упакованных слоя атомов кислорода или гидроокислов, между которыми в октаэдрической сетке расположены атомы алюминия, находящиеся на одинаковом расстоянии от соседних шести атомов кислорода или гидроксилов (рис. 33). Как уже отмечалось, атомы алюминия могут замещаться атомами железа или магния, что приводит к изменению свойств минерала.
Гидрат кремнезема построен из кремнекислородных тетраэдров, расположенных в форме бесконечно повторяющейся гексагональной сетки (рис. 34). В тетраэдре атом кремния удален от четырех атомов кислорода или гидроксилов на одинаковое расстояние.
Например, решетка кристаллов монтмориллонита и гидрослюд—трехслойна, а решетка каолинита состоит из двух слоев. Трехслойные решетки монтмориллонита связываются в пачки прослоем воды, количество которой может увеличиваться и уменьшаться, в связи с чем толщина трехслойной пачки с прослоем воды не остается постоянной. Таким образом, решетка монтмориллонита обладает подвижностью и способностью растягиваться и сжиматься. У гидрослюд часть атомов кремния замещена атомами алюминия, а освобождающаяся валентность используется на присоединение атомов калия, что укрепляет связь с соседними пачками и делает кристаллы более прочными.
Отсутствие одного из двух слоев Si—О у каолина лишает слоистую пачку симметричности и делает ее связь с соседней пачкой сравнительно прочной. В связи с этим диспергация каолиновых глин происходит хуже, чем монтмориллонитовых.
Кристаллы палыгорскита состоят из двойных цепочек (лент) кремнекислородных тетраэдров. Обе ленты соединяются между собой катионами: магнием, алюминием или железом. Палыгорскит имеет жесткую структурную решетку и поэтому может адсорбировать воду, не увеличиваясь в объеме.
Емкость обмена и электрический заряд
Атомы кремния и алюминия, входящие в кристаллическую решетку глинистых минералов, могут быть замещены другими атомами, причем не обязательно с одинаковой валентностью. В этом случае частицы глины для компенсации ненасыщенной валентности адсорбируют из водных растворов катионы. Между глиной и раствором происходит обмен катионов. При этом скорость обмена почти мгновенна.
Каждая глина обладает определенным количеством обменных ионов, т. е. вполне определенной обменной емкостью (или емкостью обмена). Обменная емкость выражается количеством молей обменных катионов, содержащихся в 1 кг сухой глины. Для наиболее распространенных глинистых минералов обменная емкость составляет: у монтмориллонита 0,8—1,5, гидрослюд — 0,1—0,4, палыгорскита 0,2—0,3, каолинита 0,03—0,15.
В глинистых минералах обменными катионами являются: Са2+, Mg2+, K+, Na+, H+, NH42+. В природных глинах основные обменные катионы — натрий или кальций, и глина получает название соответственно натриевой или кальциевой. Чистые натриевые или кальциевые глины в природе практически не существуют. Обычно глины смешанные, но влияние одного из катионов преобладает. По этому преобладающему влиянию глины относят к тому или иному типу. Тип глины во многом определяет свойства глинистого раствора при взаимодействии с веществами, содержащимися в дисперсионной среде. Возможно искусственное превращение натриевых глин в кальциевые и обратно.
При добавлении в дисперсионную среду глинистого раствора растворимых солей кальция, например хлористого кальция, последний диссоциирует с образованием двух однозарядных анионов хлора и одного двухзарядного катиона кальция. Катионы кальция притягиваются к натриевой глине значительно сильнее, чем однозарядные катионы натрия. Происходит обмен катионами. Глина становится кальциевой, а в растворе образуется хлористый натрий.
Процесс замещения кальция натрием в глине происходит сложнее. Для этого нужно брать соль натрия, с анионом которой кальций образует нерастворимое соединение. Ионы кальция связываются, и их место занимает натрий. Чаще такой перевод кальциевой глины в натриевую осуществляют с помощью кальцинированной соды.
Частицы глины при замачивании в воде приобретают отрицательный электрический заряд, который обусловливает электрокинетические явления, происходящие на поверхности глинистых частиц.
Гидрофильность и набухание глин
Все глины в той или иной мере гидрофильны. Характер гидрофильности зависит от их типа и состава и во многом определяет качество глинистого раствора.
При замачивании глины водой молекулы воды окружают поверхность кристаллов глинистых минералов, проникают между кристаллами в пачках и раздвигают их. При этом глина набухает. Набухание — предпосылка пептизации глинистых минералов при приготовлении растворов. Оно протекает в два этапа: первый — всасывание воды, второй — развитие набухания. Набухание оценивается в см3/г, измеряется на порошках глин с размером частиц 0,25 мм и менее.
Всасывание — капиллярный процесс. Для глин среднего качества всасывание длится 20—30 с, для весьма гидрофильных глин — больше. Процесс набухания зависит от типа глины: у минералов с неподвижной кристаллической решеткой набухание идет в основном за счет проникновения воды в межкристаллическое пространство, у монтмориллонита преимущественное значение имеет проникновение воды в межпакетные промежутки. Поэтому набухание у малогидрофильных глин, например у каолина, фактически заканчивается через 30— 40 с. У бентонитовых глин набухание растягивается на 2— 4 недели, причем увеличение объема может быть 20-кратным.
|
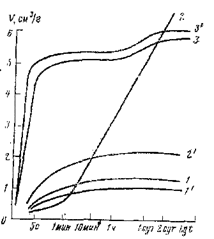
Рис. 35. Изотермы набухания глин в дистиллированной и соленой воде: 1, 2, 3 — Набухание в дистиллированной воде; 1 — кудиновская глина; 2 — аскангель; 3 — палыгорскит; 1′, 2′, 3′ — то же при набухании в 10%-ном растворе соли |

При избытке воды набухание сопровождается разрушением глины. Диполи воды своими отрицательно заряженными концами притягиваются к положительным ионам металлов или водорода. Чем меньше заряд и больше размер ионов, тем быстрее или легче они отрываются диполями воды от поверхности элементарных кристаллов. Связь между листочками в пачках нарушается, и глина «распускается» в воде.
На набухании глин отрицательно сказываются снижение рН и солевая агрессия. Так, максимум набухания у бентонитовой глины аскангель в пресной воде 17,7 раза, а в соленой в 10 раз меньше. Лишь палыгорскит одинаково хорошо набухает в пресной и соленой воде. Поэтому промывочные жидкости из палыгорскитовых глин солеустойчивы. Изотермы набухания некоторых глин в дистиллированной и соленой воде приведены на рис. 35.
Следует иметь в виду, что время протекания процессов всасывания и набухания при приготовлении глинистых растворов различно (влияет перемешивание, размеры комков глины и ее исходная влажность, состав воды и др.), но характер их протекания сохраняется. Это при прочих равных условиях определяет время приготовления раствора из каждого типа глины. Чем выше качество глины, тем дольше идет приготовление глинистого раствора.
Процессы, происходящие при набухании глин, во многом объясняют поведение стенок скважины, сложенных глинистыми породами, при контакте с промывочной жидкостью.
Размеры и форма частиц
Размеры частиц природных глин значительно меньше 0,01 мм. Более крупные зерна, которые могут присутствовать в них,— посторонняя примесь. Наибольшее влияние на свойства
глинистых растворов оказывает коллоидная фракция с размером частиц менее 1 мкм. Чем меньше размеры частиц, тем больше их качественное влияние на свойства глинистых растворов. В бентонитовых глинах содержание коллоидных фракций значительно больше, чем в каолиновых, и может достигать 40%.
Средний эффективный диаметр частиц бентонита 0,02— 0,1 мкм, каолина 0,1—1 мкм.
Коллоидальные свойства глинистых растворов определяются не только размерами частиц, но их формой. Чаще всего частицы глины имеют вид плоских или лентовидных чешуйчатых пластинок, реже — продолговатую (игольчатую) форму. Благодаря такой форме частицы имеют большую суммарную поверхность, на которой развивается свободная поверхностная энергия. Удельная поверхность глинистых минералов колеблется от 800— 900 м2/г у монтмориллонита до 10—20 м2/г — каолинита.
Требования к качеству глины для приготовления растворов
Глины используются либо в комовом виде, либо в порошковом. Размеры комков не должны превышать 150—200 мм. Глинопорошки готовят на специальных заводах механическим или физико-химическим способами. Механический способ заключается в измельчении исходной глины до заданной тонкости помола по схеме дробление — сушка — помол. Качество порошков здесь определяется главным образом качеством исходного сырья. Как правило, глинопорошки готовят из высококачественных бентонитовых глин.
Физико-химические способы получения глинопорошков пока имеют подчиненное значение. Они более трудоемки, но позволяют получать порошки из менее качественных глин. Одна из схем получения глинопорошка выглядит следующим образом: приготовление суспензии из исходного сырья — выведение из нее неактивной части — удаление жидкой фазы.
Для повышения качества глинопорошков их модифицируют путем введения при помоле веществ, улучшающих их свойства: кальцинированной соды, алюминатов, полиакрилатов и др. Тонкость помола глинопорошков должна быть такой, чтобы остаток на сите № 0071 был не более 10%. Для сохранения качества глинопорошки расфасовывают на заводе в плотные бумажные мешки.
Возможны три варианта применения порошкообразных глин.
1. Как коллоидной добавки к промывочному раствору, содержащему неглинистую твердую фазу.
2. Как добавки к глинистому раствору, приготовленному из местных низкокачественных глин, для увеличения в нем коллоидной фракции.
3. Как единственной твердой фазы раствора, если в районе работ нет близко пригодных глин, а доставка их затруднена.
Глины характеризуются выходом раствора Qp — количеством кубических метров раствора заданной условной вязкости, — получаемого из 1 т массы. Чаще в качестве эталонной условной вязкости глинистого раствора принимают величину 25 с. Тогда
Qp = 630/(рp—1000), (V.1)
Где рр — плотность раствора при условной вязкости 25 с, кг/м3.
Выход раствора колеблется от 2—3 м3/т из каолиновых комовых глин до 19 м3/т из высококачественных модифицированных глинопорошков.
Качество (пригодность) глин для приготовления растворов оценивается несколькими методами. Простейшим является оценка путем приготовления и исследования раствора из пробы глины. Для этого готовят несколько образцов раствора одинаковой вязкости и измеряют остальные параметры. Дополнительно оценивается возможность регулирования свойств приготовленных растворов. При этом основное внимание уделяется возможности получения главных, определяющих для данных условий параметров раствора.
И. Н. Резниченко предложил оценивать глины по содержанию в них активного коллоидного комплекса (по коэффициенту К)
K = B/59, (V.2)
Где В — величина адсорбции метиленовой сини исследуемой глины, см3/г; 59 — эталонная величина адсорбции метиленовой сини коллоидных частиц наиболее качественного саригюхcкого бентонита в дистиллированной воде, см3.
Величина К Для бентонитовых глин должна быть более 0,6. Для глин прочих типов K ≤ 0,3.
Между содержанием глины С И значением К Установлена зависимость
GK = СK = Const, (V.3)
Где GK — объемное содержание коллоидного глинистого компонента, %.
Считается, что получение качественного раствора возможно при соблюдении следующих соотношений между коллоидной составляющей К И общим содержанием твердой фазы С:
К ≥0,4; 2,3≤С≤5,0.
С = рР/рВ, (V.4)
Где рр, рв — плотности соответственно глинистого раствора и воды, на которой он приготовлен.
Качество глин с учетом характера основных деформаций, происходящих в глинистом растворе, оценивается следующим образом. По соотношению быстрых эластических ε0‘, медленных эластических ε2‘ И пластических ε1‘T (при T =1000 с) деформаций все глины делятся на шесть типов: нулевой — εo‘<ε2‘<ε1‘T; первый — ε2‘>ε0‘>ε1‘T; второй — ε2‘>ε‘T>ε0‘; третий — е0‘> >ε1‘T>ε2‘; четвертый — ε1‘T>ε0‘>ε2‘; пятый — ε1‘>ε2‘>ε0‘. Устойчивые растворы относятся к нулевому, третьему и четвертому структурно-механическим типам.
Требование к качеству воды для приготовления глинистых растворов
Требования к качеству воды обусловлены составом глинистого раствора и условиями его применения. Возможно использование морской воды и пластовых вод — рапы с общей минерализацией более 3%. В то же время для приготовления пресных качественных глинистых растворов целесообразно использовать воду с общей жесткостью до (3÷4) 10-3 моль/л. При большей жесткости воду необходимо предварительно смягчать.