 Измерение электропроводимости и солености воды кондуктометрическим способом
Измерение электропроводимости и солености воды кондуктометрическим способом
Измерение электропроводимости и солености воды кондуктометрическим способом
Вопрос:
Уже который раз обращаюсь к Вам за помощью… Надеюсь отыскать ответ и на этот вопрос, а поточнее просьбу. Я студентка ТТИ ЮФУ, кафедры химии и экологии. Выполняя лабораторную работу на тему «измерение электропроводимости и солености воды кондуктометрическим способом», я не смогла найти электропроводимость стандартных смесей кондуктометром ОК-102/1 Венгерского производства в виду несовершенства лабораторных критерий, ну и прибор дает огромную погрешность.
В экспериментальной части работы были приготовлены 4 стандарных раствора. Для этого было рассчитано разбавление 5%-ного начального раствора NaCl до получения раствора данной концентрации. Общий объем стандартного раствора равен 100 мл. Т.е. 1 хим.стакан – 10 мл NaCl и 90 мл дистиллированной воды; 2 — 20 и 80; 3 — 25 и 75; 4 — 40 и 60. Дальше должна быть измерена электропроводимость каждого из стандартных смесей и построен калибровочный график(зависимость электропроводимости от концентрации). Последующие этапы работы, а конкретно измерение значения электропроводимости анализируемого раствора — воды Таганрогского залива — я сделаю сама уже как получится на имеющемся приборе. А к Вам просьба, определите, пожалуйста, значения электропроводимости стандартных смесей, если Вам это легко и позволяет время. Если же нет — ничего. Тогда просто подскажите современный прибор для таких изверений и его цена.
P.S.: Обращаюсь к Вам с схожей просьбой не поэтому, что мне лень либо я не знаю, как провести измерения, а так как не получаются достоверные значения в критериях лаборатории нашей кафедры. Снова благодарю Вас за всю помощь, которую Вы мне оказали!
Карина
Ответ:
Почетаемая, Карина!
Электрометрический способ определения солёности основан на измерении относительной электропроводности морской воды при помощи специального прибора — кондуктометра, что позволяет ускорить и в принципе прирастить точность ее определения по сопоставлению с другими способами.
Принцип деяния кондуктометра основан на прямой зависимости электроводности воды (силы тока в неизменном электронном поле, создаваемом электродами прибора) от количества растворенных в воде соединений. Широкий диапазон соответственного оборудования позволяет на данный момент определять проводимость фактически хоть какой воды, от сверхчистой (очень низкая проводимость) до насыщенной хим соединениями (высочайшая проводимость).
Сейчас кондуктометр можно приобрести даже в зоомагазинах, при всем этом вероятны композиции такового прибора с рН метром. Не считая того, таковой прибор можно приобрести в конторах и фирмах, торгующих оборудованием для экологических исследовательских работ www.tdsmeter.ru/com100.html.
 Умельцы, отлично владеющие паяльничком, могут сами сделать прибор для измерения электропроводности конструкции И.И.Ванюшина. (журнальчик «Рыбное хозяйство», 1990 г., №5, стр. 66-67. Не считая того, во всех деталях это устройство и методы его калибровки описаны в очень полезной книжке «Современный аквариум и химия», создатели И.Г.Хомченко, А.В.Трифонов, Б.Н.Разуваев, Москва, 1997 г). Прибор изготовлен на всераспространенной микросхеме К157УД2, которая представляет собой два операционных усилителя. На первом собран генератор переменного тока, на втором – усилитель по стандартной схеме, с которого снимаются показания цифровым либо аналоговым вольтметром.
Умельцы, отлично владеющие паяльничком, могут сами сделать прибор для измерения электропроводности конструкции И.И.Ванюшина. (журнальчик «Рыбное хозяйство», 1990 г., №5, стр. 66-67. Не считая того, во всех деталях это устройство и методы его калибровки описаны в очень полезной книжке «Современный аквариум и химия», создатели И.Г.Хомченко, А.В.Трифонов, Б.Н.Разуваев, Москва, 1997 г). Прибор изготовлен на всераспространенной микросхеме К157УД2, которая представляет собой два операционных усилителя. На первом собран генератор переменного тока, на втором – усилитель по стандартной схеме, с которого снимаются показания цифровым либо аналоговым вольтметром.
Соленостью морской воды (S‰) именуют выраженную в граммах суммарную массу всех жестких растворенных веществ, содержащихся в 1 кг морской воды, при условии, что все твердые вещества высушены до неизменной массы при 480 °С, органические соединения стопроцентно минерализованы, бромиды и иодиды изменены эквивалентной массой хлоридов, а карбонаты превращены в окислы. Как следует, морская вода в реальности содержит малость больше солей по сопоставлению с определенными таким макаром значениями солёности.
Соленость может изменяться в очень значимых границах, и все же соотношение отдельных компонент солевого состава морской воды остается фактически неизменным, кроме очень опресненных районов, прилегающих к устьям рек.
Вообщем электропроводность охарактеризовывает общее содержание растворенных солей в воде (в том числе и тех, которые обусловливают твердость воды). Электронная проводимость природной воды зависит в главном от концентрации растворенных минеральных солей и температуры. Природные воды представляют в главном смеси консистенций сильных электролитов. Минеральную часть воды составляют ионы Na+, K+, Ca2+, Cl-, SO42-, HCO3- . Этими ионами и обуславливается электропроводность природных вод. Присутствие других ионов, к примеру, Fe3+, Fe2+, Mn2+, Al3+, NO3-, HPO4-, H2PO4- не очень оказывает влияние на электропроводность, если эти ионы не содержатся в воде в значимых количествах. На достоверность оценки содержания минеральных солей по электропроводности в большой степени оказывают влияние температура и неодинаковая электропроводимость разных солей.
До этого, чем поведать об измерении электропроводности воды, скажу о всераспространенной ошибке, нередко встречающейся в литературе.
Для свойства воды следует знать не электропроводность S, а удельную электропроводность ?, которая относится к единице длины проводника (либо к 1 см слоя воды либо раствора). Значение S измеряется в сименсах (См) либо микросименсах (мкСм), а ? — в мкСм/см.
УДЕЛЬНАЯ ЭЛЕКТРОПРОВОДНОСТЬ ВОДЫ – инструментально определяемая черта минерализации морской воды. Это величина, оборотная удельному сопротивлению.
Удельная проводимость неких смесей 1000 мг. в л.:
Стандартным веществом для измерения проводимости является раствор хлорида калия (KCI), проводимость которого с высочайшей точностью измерена при помощи ASTM Standard D1125-77.
Точно измеренное количество сухого KCI должно быть растворено в известном количестве воды в мерной пробирке. Обычно, обычная удельная проводимость результирующего раствора будет близка к свидетельствам таблицы, но не будет совпадать с ними из-за трассировки проводимости в применяемой дистиллированной воде, так к примеру, 0.01 N KCI обычно принимается за 1413 мкС/см 25 C°.
Удельная проводимость (либо удельная электролитическая проводимость) определяется, как способность вещества проводить электронный ток. Это величина, оборотная удельному сопротивлению.
При хим очищении воды очень принципиально измерить удельную проводимость воды, зависящую от растворенных в воде ионных соединений.
Удельная проводимость просто может быть измерена электрическими устройствами. Широкий диапазон соответственного оборудования позволяет на данный момент определять проводимость фактически хоть какой воды, от сверхчистой (очень низкая проводимость) до насыщенной хим соединениями (высочайшая проводимость).
Удельная электропроводность воды измеряется с помощью платиновых либо железных электродов, погружаемых в воду, через которые пропускается переменный ток частотой от 50 Гц (в маломинерализованной воде) до 2000 Гц и поболее (в соленой воде), методом измерения электронного сопротивления. Для исключения воздействия температуры измерения выполняются при неизменной температуре 15 0С (в океанологии), 18 0С (в Рф, но в неких забугорных странах — при 20 0 либо 25 0С), или приводятся к ней с внедрением эмпирических формул.
Расчет удельной электропроводности воды делается по формуле:
? = CK / RX
где Cк — емкость датчика прибора, зависящий от материала и размеров электродов и имеющий размерность см-1, определяется при тарировке прибора по растворам хлористого калия с известной величиной удельной электропроводности; K — температурный коэффициент для приведения измеренной величины при хоть какой температуре к принятому неизменному ее значению; R — измеренное электронное сопротивление воды прибором, в Омах.
Удельную электропроводность солёной воды принято выражать в См/м (См — Сименс, величина, оборотная Ому), пресной воды — в микросименсах (мкСм/см). Удельная электропроводность дистиллированной воды равна 2—5 мкСм/см, осадков — от 6 до 30 мкСм/см и поболее, в районах с очень грязной воздушной средой, речных и пресных озерных вод 20—800 мкСм/см.»
Прибор нужно отградуировать в значениях сопротивления. Для градуировки можно советовать последующие сопротивления: 1 кОм (электропроводность 1000 мкСм), 4 кОм (250 мкСм), 10 кОм (100 мкСм).
Для того, чтоб поточнее найти удельную электропроводность, необходимо знать постоянную сосуда для измерения СX. Приготовьте 0,01 М раствора хлорида калия (KCl) и определите его электросопротивление RKCl, (в кОм) в приготовленной ячейке. Неизменная сосуда определяется по формуле:
CK = RKCl • ?KCl
где ?KCl, — удельная электропроводность 0,01М раствора KCl при данной температуре в мкСм/см, приведенная в табл. 24.
Сейчас, если вы измерили сопротивление эталона раствора либо воды RX (в кОм), то удельная электропроводность находится по формуле:
? = CK / RX
Приобретенное значение электропроводности будет соответствовать температуре 20 °С. Если температура воды другая, то измеренное значение нужно помножить на поправочный коэффициент (эти коэффициенты приведены в таблицах). Тогда итог будет приведен к температуре 20 °С.
Таблица. Удельная электропроводность 0,01 М аква раствора хлорида калия
Таблица. Поправочные коэффициенты для электропроводности при различной температуре
Имеются различные варианты способа определения солёности воды. Сущность этих способов заключается в том, растворенные в воде ионы, являясь заряженными частичками, могут проводить электричество, чем больше в воде ионов, тем выше в ней содержание растворимых веществ и тем выше ее электропроводность и, соответственно, ниже сопротивление. Электропроводность «S» — величина оборотная электронному сопротивлению «R»:
S=1/R.
 Солёность воды охарактеризовывает удельная электропроводность ?, которая относится к единице длины проводника (в нашем случае к 1 см слоя воды).
Солёность воды охарактеризовывает удельная электропроводность ?, которая относится к единице длины проводника (в нашем случае к 1 см слоя воды).
Для ориентировочной оценки солёности воды можно придерживаться такового эмпирически отысканного соотношения:
Содержание солей (мг/л) = 0.65 мкСм/cм
Другими словами, для определения содержания солей измеренную величину проводимости множат на коэффициент 0,65. При всем этом величина этого коэффициента колеблется зависимо от типа вод в спектре 0.55-0.75.
Смеси хлористого натрия проводят ток лучше:
Содержание NaCl (мг/л) = 0.53 мкСм/cм
либо 1 мг/л NaCl обеспечивает электропроводность в 1.9 мкСм/cм.
Относительно калибровочного графика, он приведён в одной научной книжке:
Рис. Зависимость соотношения удельное сопротивление/проводимость от содержания растворенного NaCl при 20°С (Набросок из книжки Ф.Берне, .Ж.Кардонье «Водоочистка», Москва, «Химия», 1997)
И графика видно, что 1 мг/л NaCl обеспечивает удельную электропроводность раствора, примерно равную 2.3 мкСм/cм. Данные о хлористом натрии довольно животрепещущи, потому что если вылечивать рыбок при помощи длительных солевых ванн в общем аквариуме и подменивать в нем часто воду, то через некое время появляется необходимость оценить, сколько же осталось соли в воде? Приведенные выше коэффициенты позволяют, хоть и примерно, сделать такую оценку.
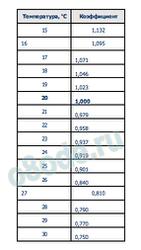 Но, как я уже произнес выше, электропроводность растет с повышением температуры и при измерениях ее нужно учесть. При повышении температуры на 1°С, электропроводность возрастает примерно на 2%.
Но, как я уже произнес выше, электропроводность растет с повышением температуры и при измерениях ее нужно учесть. При повышении температуры на 1°С, электропроводность возрастает примерно на 2%.
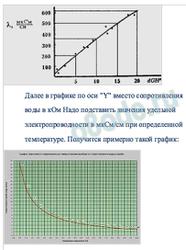
По удельной электропроводности воды можно оценить и общую твердость воды. Ниже представлен график зависимости dGH и электропроводности (И.Г.Хомченко, А.В.Трифонов, Б.Н.Разуваев «Современный аквариум и химия»).
Дальше в графике по оси «Y» заместо сопротивления воды в кОм Нужно подставить значения удельной электропроводности в мкСм/см при определенной температуре. Получится приблизительно таковой график:
При обнаружении разброса показаний прибора рекомендую Вам делать повторные калибровки прибора по обычной воде через каждые 10—15 проб. Если прибор работает размеренно, то его проверку можно создавать пореже, через 20—30 проб.
 По окончании анализа всей серии проб инспектируют калибровку солемера, после этого ячейку пару раз промывают дистиллированной водой.
По окончании анализа всей серии проб инспектируют калибровку солемера, после этого ячейку пару раз промывают дистиллированной водой.
Также припоминаю, что солёность морской воды может быть измерена и аргентометрическим способом, который основан на нахождении хлорности морской воды (Cl ‰), под которой понимают суммарную массу в граммах галогенидов (хлорида, бромида и иодида) кроме фторида, содержащихся в 1 кг морской воды в пересчёте на эквивалентное содержание хлоридов. При всем этом хлорность определяют титрованием пробы морской воды веществом нитрата серебра AgNO3 до полного осаждения всех галогенидов, не считая фторида. Но, результаты вычислений солёности морской воды электрометрическим либо аргентометрическим способами определения солёности могут существенно отличаться друг от друга.
Говоря о солёности вод Таганрогского залива, долголетний ход солености вод Азовского моря являлся предметом исследования целого ряда создателей . Расхождения в среднегодовых значениях солености открытой части моря, приобретенные разными создателями, почти всегда невелики. Наибольшие из их составляют 0,6 ‰.
Солёность Азовского моря характеризуется большой временной и пространственной изменчивостью. Межгодовые конфигурации средней солености моря без Таганрогского залива добиваются 0,7…+ 0,9o/oo, а в отдельные годы даже 1o/oo (1979 г.). В Таганрогском заливе размах межгодовых конфигураций средней солёности добивается 2,0 — 2,5o/oo с максимумом 3,6o/oo (1969 г.) . Долголетний размах среднегодовых значений солености моря по имеющемуся ряду наблюдений (19281939, 1947 -1989 гг.) составляет 4,3o/oo (9,6o/oo в 1933 и 1934 гг. и 13,9o/oo в 1976г.). В Таганрогском заливе этот размах равен 6,9o/oo.
Бассейн Азовского моря представляет собой широкий район тесноватого взаимодействия развитых аграрно-промышленных комплексов и морской экосистемы. Вследствие малых размеров моря и его маленьких глубин главные элементы гидрологического и гидрохимического режима моря и состояние экосистемы подвержены значимым антропогенным изменениям. По режиму солености, а именно, принято выделять период до ввода в строй Цимлянского гидроузла (19221952 гг.) и после него.
Относительно большой приток речных вод, который до 1952 г. (при сравнимо маленьких невозвратных изъятиях стока) составлял в среднем более 40 км3 в год, обусловливал пониженную дескатьёность в море: в среднем 10,9o/oo , при максимуме 12,3o/oo (1951 г.) и минимуме 9,6o/oo (1932, 1933 гг.). В Таганрогском заливе средняя солёность за этот период составляла 6,2o/oo и изменялась от 8,5o/oo в 1950 г. до 4,2o/oo в 1947 г.
После строительства Цимлянского гидроузла и воплощения других водохозяйственных мероприятий в бассейнах рек Дона и Кубани в период 19531989 гг. средняя солёность моря возросла до 12,1o/oo и изменялась от 13,9o/oo в 1976г. до 11,1 o/oo в 1965 и 1982 гг. В Таганрогском заливе произошли подобные конфигурации солености. Средняя солёность возросла до 7,5o/oo, наибольшая до 11,1 o/oo (1976г.), малая до 4,3 o/oo (1964 г.). Дополнительной чертой изменчивости солености могут служить значения линейного тренда, вычисленные для разных периодов.
I период -19521955 г., когда колебания речного стока составили 2850 км3 , солёность моря возросла, а различия меж среднегодовыми значениями солености уменьшились до 0,7o/oo (0,14o/oo /год).
II период -18561966 г., — когда колебания речного стока составили 30 -54 км3 , солёность несколько миниатюризируется, линейный тренд приблизительно равен 0,414o/oo /год .
III период -19671976 гг. — характеризуется неуклонным повышением солености с 11,5 o/oo до 13,9 o/oo . Колебания речного стока составили 2044 км 3. Для данного периода был также рассчитан линейный тренд солености, который оказался равным 3,4 o/oo ,
При рассмотрении пространственного рассредотачивания значений среднегодовой солености в Азовском море в самом неблагоприятном 1976 г. установлено, что площадь с соленостью вод, не превосходящей 7 o/oo , сократилась до 1,3 тыс. км2 а с соленостью, не превосходящей 11 o/oo ,до 3 тыс. км2. Сразу около 20 тыс. км2 фактически Азовского моря занимали воды соленостью 1314 o/oo , около 12 тыс. км2воды соленостью 1414,4 o/oo . Около 40% площади Таганрогского залива были заняты водами соленостью 1113 o/oo . Таким макаром, по данным АзНИИРХ, для всех популяций полупроходных рыб и молоди осетровых удовлетворительные условия по солености в рассматриваемый период сохранились только на малозначительной части акватории Таганрогского залива.
IV период -19771982 гг. — характеризуется резким понижением солености с 13,9 o/oo до 11,1 o/oo . При всем этом колебания речного стока составили от 32 до 50 км3. В 19831989 гг. солёность изменялась в границах 11,4 o/oo — 12,1 o/oo . Средняя за 80-е годы солёность фактически Азовского моря составляла 11,7 o/oo , а Таганрогского залива -7,2 o/oo .
Начиная с 1979 г. существенно расширились зоны с соленостью вод, не превосходящей 7 o/oo (до 3,3 тыс. км2), 9 o/oo (до 4,1 тыс. км2), 11 o/oo — до 5,4 тыс. км2, 12 o/oo -9,7 тыс. км2. Аналогичное пространственное рассредотачивание солености по акватории Азовского моря сохранилось в 1980 г. и в следующие годы. В 1981 г. в фактически Азовском море солёность более 12 o/oo наблюдалась исключительно в маленьком районе, конкретно примыкающем к Керченскому проливу. Пространственное рассредотачивание солености в Азовском море в разные периоды.
Общее уравнение солевого баланса Азовского моря записывается в последующем виде:
Тут не учтены подземная составляющая, приход солей с атмосферными осадками и уход в атмосферу с испарением из-за их незначительности, также выпадение сухих солей из атмосферы (к примеру, во время пылевых бурь) вследствие отсутствия данных.
При расчетах солевого баланса были приняты последующие значения солености (минерализации) и плотности составляющих:
Дальше по изменению содержания солей в море ( , ) рассчитывалось изменение солености в реальном году.
Результаты расчетов солевого баланса приводятся в таблице ( Современный солевой баланс и солёность Азовского моря, млн.т ). Из данных таблицы следует, что ведущая роль как в приходной, так и в расходной частях принадлежит солеобмену через Керченский пролив. В приходной части он составляет 96%, а в расходной -98%.
В текущее время солёность азовских вод распределяется последующим образом. На глубинах прикерченского района Азовского моря, куда поступает более соленая черноморская вода, солёность добивается 17,5°/оо. Вся центральная часть моря очень однородна по солености,она тут составляет 12-12,5°/оо. Только малозначительная область здесь имеет солёность 13°/оо. В Таганрогском заливе солёность снижается к устью Дона до 1,3 °/оо. На границе Таганрогского залива средняя годичная солёность составляет около 9%, в центральных частях моря 11%.
Несколько огромную солёность отмечают в районе меж полуостровом Бирючий и северной частью Арабатской Стрелки, куда при сильных западных ветрах через пролив Узкий временами поступают более соленые воды Сиваша. К юго-востоку, к Кубанской дельте, отмечается некое уменьшение солености. Неоднородность рассредотачивания солености по вертикали отмечается в большей степени весной. В северной части Керченского пролива солёность почти всегда составляет 13-14%. Весной при сильных ветрах солёность меняется существенно. Сезонные конфигурации солености в Азовском море до сотворения водохранилищ и зарегулирования стока рек Дона и Кубани были значительны, сейчас они несколько уменьшились.
Температура поверхностного слоя Азовского моря имеет отлично выраженный годичный ход. Более низкая температура воды наблюдается в январе — феврале и составляет в большей части моря 0 °С либо малость ниже; только в его южной части в это время сохраняется положительная температура воды (1—3°С), хотя и тут в грозные зимы она может снижаться до —0,3 °С. С марта температура стремительно увеличивается и в мае добивается 18 °С. Летом температура воды в открытом море составляет в большей степени 22—25 °С, а в прибрежной зоне добивается 32 °С. Со 2-ой половины августа она начинает приметно снижаться и в ноябре составляет 6—10°С. В Керченском проливе в осенне-зимний период температура воды обычно на 2—4 °С выше, чем в открытом море. В летние месяцы в итоге водообмена меж Азовским и Черным морями температура воды в проливе ниже, чем в прибрежной зоне моря.
Весной и сначала лета вследствие таяния льдов и огромного притока речных вод солёность снижается. Осенью и зимой она практически схожа от поверхности до дна моря на большенном протяжении. Большая солёность наблюдается в обособленном мелководном заливе Азовского моря Сиваше, меньшая — в Таганрогском заливе.
Солёность поверхностного слоя моря малозначительна. В последние годы она повысилась в итоге зарегулирования стока рек Дон и Кубань и составляет в главном 10—12 °/оо; в 1974 г. в центральном районе моря солёность достигала 14 °/оо — В Таганрогском заливе она меняется от 1—2 °/оо в верхушке залива до 9—10 °/оо при выходе из него. В заливе Сиваш солёность воды колеблется от 25 °/оо в его северной части до 180 °/оо в южной.
Сезонные колебания солености обычно изредка превосходят 1 °/оо; они более значительны в Таганрогском заливе, где достаточно велико воздействие стока реки Дон.
Плотность поверхностного слоя моря большая в декабре — марте и составляет в центральной части моря 1,007—1,009. В прибрежной зоне плотность воды в декабре—марте 1,006—1,014, в июне—августе 1,001—1,007. В Таганрогском заливе летом плотность воды 0,998. В текущее время в связи с повышением солености воды наметилось также приметное повышение ее плотности.
Не считая солей и минеральных веществ, воды Азовского моря содержат много биогенных частей (другими словами частей органического происхождения), приносимых в море в главном реками. К этим элементам относятся фосфор, азот и кремний. Учеными подсчитано, что реки и воды Темного моря и осадки приносят в Азовское море 17139 т фосфора, 75316 т азота и 119694 т кремния. Часть этих веществ выносится в Темное море, часть изымается из моря совместно с выловленной рыбой, но большая часть откладывается в грунт на деньке Азовского моря. Так, фосфора откладывается около 13 тыс. тонн, азота — около 31 тыс. и кремния — выше 82 тыс. тонн.
Достояние Азовского моря биогенными субстанциями делает подходящие условия для развития жизни в этом море. Это разъясняется мелководностью, высочайшей био продуктивностью. Все это делает подходящие условия для восстановительных процессов.
В качестве примера разглядим отысканный мною в вебе расчёт среднемесячной солености воды Таганрогского залива для МГ Ейск. В качестве входных (независящих черт) выбраны последующие причины: среднемесячный расход воды р. Дон за предыдущий месяц (Х1), температура воды (Х2), ветровой параметр, определяющий сгонно-нагонные явления залива (Х3), солёность воды предыдущего месяца, определяющая исходные условия (Х4). Среднемесячные расходы воды р. Дон выбраны с учетом времени добегания распресняющего воздействия стока, которое для МГ Ейска равно двум месяцам.
В качестве выходной свойства выступает солёность воды Таганрогского залива для МГ Ейск в текущем месяце ().
Уравнение разыскиваемой зависимости будет иметь вид
Рис. Фактическая (1) и расчётная (2) среднемесячная солёность воды Таганрогского залива для МГ Ейск за период 1966 по 2000 гг.
По приобретенной зависимости на рисунке приведены фактические и расчётные значения среднемесячной солености воды Таганрогского залива.
Коэффициент корреляции меж наблюденными и расчётными значениями равен 0,89 с доверительными интервалами 0,858 и 0,916. Точность приобретенных результатов хорошо согласуется с фактическими данными наблюдений по МГ Ейск (отклонение не превосходит 25-30 %). Приобретенное уравнение также испытано на независящем материале (ряд из 66 членов). Коэффициент корреляции меж наблюденными и расчётными значениями оказался равным 0,86.
Расчёт среднемесячной солености воды Таганрогского залива для МГ Таганрога выполнен аналогично предшествующему расчёту.
Фазу снижения солености воды, вызванную половодным стоком р. Дон, охарактеризовывает среднемесячная солёность июня (y). В качестве предикторов для уравнения множественной регрессии выбраны: суммарный сток р. Дон за половодье (Qпол) с учётом времени добегания распресняющего воздействия стока, солёность воды, наблюдающаяся до воздействия стока половодья (Sпол) (среднемесячная солёность марта для МГ Таганрог) и ветровой параметр (Vp).
Общее уравнение разыскиваемой зависимости солености воды для МГ Таганрога в июне t — года будет иметь вид
yt = 1,89 + 0,38 Sпол – 0,0006 Qпол + 0,0003 Vp.
Коэффициент множественной корреляции меж фактическими и расчётными значения среднемесячной солености воды в июне для МГ Таганрог равен 0,74.
В итоге проведенной оценки конфигурации солености воды по акватории Таганогского залива исследователи установили, что солёность воды имеет более тесноватую положительную корреляцию с соленостью воды предшествующего месячного периода, отрицательную – с месячным речным стоком р. Дон и поболее слабенькую отрицательную корреляцию с температурой воды залива. Воздействие стока р. Дон на солёность воды залива находится в зависимости от периода года: сток значим в период половодья, что более типично для восточной части Таганрогского залива, расположенной поблизости устья р. Дон и теряет своё воздействие в меженный период. Ветровой параметр, определяющий сгонно-нагонные явления, взятый в интервале дискретности один месяц для данного расчёта, оказался статистически незначим. Достоверность приобретенных результатов подтверждается сопоставлением расчётных и наблюденных данных.
Надеюсь, эти данные Вам понадобятся как будущему экологу.
С почтением,
к.х.н. О.В. Мосин
ПРИЛОЖЕНИЕ:
Практическая соленость — S
Практическая соленость определяется через отношение электропроводностей пробы морской воды при атмосферном давлении и 150С и раствора КСl , содержащего 32,4356 г КСl в массе раствора 1 кг при тех же давлениях и температуре (при использовании Интернациональной Практической шкалы температуры 1968 г.). Отношение K15 определяет практическую соленость пробы в согласовании с зависимостью:
S = a0 +a1*K151/2 +a2*K15 +a3*K153/2 + +a4*K152 +a5*K155/2
Где
a0 = 0.0080 a1 = — 0.1692
a2 = 25.3851 a3 = 14.0941
a4 = — 7.0261 a5 = 2.7081
? ai = 35
2 ? S ? 42
Соленость по Кнудсену, Соренсену и Форху
S = 0.030 + 1.8050*Cl…………. ….(1)
S = a + b*Cl……………………….. (2)
S = b*Cl………………………..… …(3)
bCl = 0,03 + 1,8050Cl = 35%o.
S = 1,80655*Cl…………………… (4)
Соленость как Сумма ионов
? = 0,073 + 1,8110*Cl (5)
? = 1,8148*Cl (6)
Сумма ионов и соленость по Кнудсену
Cl- = 0,0000 + 0,99894*Cl Cl-+ Br+ F= 0,0000 + 1,0000*Cl
Br- = 0,0000 + 0,00340*Cl
F- = 0,0000 + 0,00001*Cl
HCO3= 0,0493 + 0,00476*Cl O = 0,0069 + 0,00162*Cl
H3BO3 = 0,0000 + 0,00137*Cl B2O3 = 0,0000 + 0,00076*Cl
SO42- = 0,0061 + 0,13910*Cl SO42= 0,0061 + 0,13910*Cl
Ca2+ = 0,0154 + 0,02025*Cl Ca2+ = 0,0154 + 0,02025*Cl
Mg2+ = 0, 0020 + 0,06680*Cl Mg2+= 0,0020 + 0,06680*Cl
K+ = 0,0000 + 0,02000*Cl K+ = 0,0000 + 0,02000*Cl
Sr2+ = 0,0000 + 0,00070*Cl Sr2+ = 0,0000 + 0,00070*Cl
Na+ = 0,0000 + 0,55560*Cl Na+ = 0,0000 + 0,55560*Cl
——————————————————————————————————__________________________ _______________________
? = 0,0728 + 1,8110 Сl (5a) S = 0,0304 + 1,80483 Cl (1a)
? = 1,00455*S (7),
Определения солёности Каспийского моря
Формула А.А. Лебединского
S = 2, 38*Cl (8 )
Формула С.В.Бруевича
S = 2.386 Cl (9)
Формула А.В.Трофимова
S = 0,14 + 2,36Cl (10)
А.Пахомова и Б.Затучная (1960 гг):
Sпахом = 0.319 + 2.3464*Cl (11 )
Л.Друмова (1980 гг):
Sдрум = 0.3114 + 2.1762*Cl + 0,0229*Cl2 ( 12 )
Sдрум = 0.408 + 2.1948*Cl + 0.0229*Cl2 ( 13 )
А.Скороход (1996 г):
S1скор = 0.221 + 2.394*Cl ( 14 )
S2скор = 0.172 + 2.45*Cl + 0.0102*Cl 2 ( 15 )
DS1 = Sдрум – Sтроф. = 0.1714 – 0.1838*Cl + 0.0229*Cl2,
DS2 = Sдрум – Sтроф. = 0.268 – 0.1652*Cl + 0.0229*C 2,
DS3 = SБруевич – Sтроф. = — 0.14 + 0.026*Cl ,
DS4 = S1скор — Sтроф. = 0.081 + 0.034*Cl,
DS5 = S2скор — Sтроф. = 0.032 + 0.09*Cl — 0.0102*C 2
DS6 = SпахомSтроф. = 0.179 — 0.014*Cl,
Разница значений солёности, определенной по формулам разных исследователей и формуле А.Трофимова
Отношение суммы ионов к солёности Кнудсена-Соренсена
1) Лебединцев в пересчете С.Бруевича и
А. Пахомовой:
S/S = 2.42/3.286 = 1.0425
2) Л. Друмова
S/S = 1.0155
Определение солёности через относительную электропроводность (Л.Друмова, 1983)
S = -0.0986 + 30.7336R20 +13.6703R202
(для R20 = 0.12?0.45) (22)
Методическая ошибка определения солёности составляет +( от 0.19 до 0.15%о) при изменении
Сl от 4.5 до 5.5 %о
Определения соотношения SКасп и Sокеан
?Касп = (1.142 ± 0.003)* Sокеан. (23)
?Касп /SКасп = (2.42?2.40)/2.386= =(1.01425?1.00587) (24)
?Касп =(1.01425?1.00587)* SКасп (25)
SКасп = [(1.126?1.135) ± 0.003] * Sокеан (26)
Для Cl = 5.25 до 5.45%о –обычная вода Каспия
Хлорный коэффициент равен 2.415, тогда
SКасп = [(1.128± 0.003] * Sокеан (27)
Метод расчета практической солёности по данным СТD-измерения
S =a0+a1RТ1/2+a2RТ+a3RТ3/2 +a4RТ2+a5RТ5/2+ ?S (28),
где
?S =(Т-15)/[1+k(Т-15)]*(b0+b1RТ1/2+b2RТ+b3RТ3/2+
+b4RТ2+b5RТ5/2) (29),
при всем этом константы ai определены в уравнении определения практической солёности:
b0 = 0.0005
b1 = — 0.0056
b2 = — 0.0066 k = 0.0162
b3 = — 0.0375
b4 = — 0.0636
b5 = — 0.0144
?bi = — 0.0000