 ОСНОВНЫЕ ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ. РАВНОВЕСНЫЕ ПРОЦЕССЫ
ОСНОВНЫЕ ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ. РАВНОВЕСНЫЕ ПРОЦЕССЫ
В первом приближении ЭХГ может быть рассмотрен в сопоставлении с некоторой теплосиловой установкой. В отличие от обычной теплосиловой установки в ЭХГ реакции между топливом и окислителем локально разделены (т. е. протекают на разных электродах); в системе отсутствует стадия выделения и превращения тепловой энергии. С термодинамической точки зрения последнее обстоятельство позволяет рассматривать ЭХГ как одно — 38
температурную систему (обычная теплосиловая установка всегда, по крайней мере, двухтемпературная система).
Соответственно этому изменяется и роль окружающей среды, которая в зависимости от обстоятельств может быть как теплоприемником, так и источником теплоты (в обычной теплосиловой установке окружающая среда всегда теплоприемник). Последнее замечание означает, что при определенных условиях часть энергии окружающего пространства может быть преобразована в электрическую.
Термодинамика обратимых, т. е. равновесных процессов без самопроизвольных реакций, позволяет определить несколько важных для практики параметров ТЭ, в том числе КПД г) и ЭДС Е0. Для описания равновесного процесса мы представляем ТЭ в виде двух электродов, находящихся в контакте с электролитом и соединенных внешней цепью. Под напряжением такого ТЭ будем понимать разность потенциалов между конечными металлами, причем металлы эти должны быть одинаковы. Потенциал отдельного электрода может быть определен также по отношению к некоторому другому, названному электродом сравнения (за такой обычно принимают водородный электрод). Величина Лср=срі—qa—U и будет являться рабочим напряжением ТЭ.
Чрезвычайно важным является то обстоятельство, что хотя отдельные потенциалы ф, называемые внутренними потенциалами или потенциалами Гальвапи, мы измерять не можем (ф — потенциал внутри фазы, отнесенный к бесконечно удаленной точке в незаряженном вакууме, и при переходе через границу фаз необходимо учесть неизвестную работу по перемещению заряда), но разность Дф поддается измерению. Равновесное состояние, характеризующее Дф=£’0, не является статическим: даже при суммарном токе, равном нулю, происходит реакция на электроде, причем через границу осуществляется обмен носителями. Образующийся «равновесный» ток назван током обмена /о. Физически он характеризует скорость установления потенциала электрода и его чувствительность к нарушению равновесия. Нашей дальнейшей целью будет определение значения ЭДС.
Введем несколько термодинамических параметров, характеризующих поведение равновесного ТЭ [2.1, 2.2]. Во-первых, отметим, что ТЭ работает в изобарно-изотер
мическом режиме. Это означает, что в нем давление и температура процесса — постоянные величины, p=const, Т = const.
Термодинамика позволяет описать такие процессы (с двумя постоянными параметрами системы) некоторыми так называемыми характеристическими функциями Ф. Основное достоинство этих функций — возможность расчета их изменения ДФ=гФі—Ф2 вне зависимости от «пути» процесса (математически это означает существование полного дифференциала йф). Таким образом, зная Фі и Ф2 в начале и конце процесса, можно вычислить АФ при любом характере изменения этого параметра. Для изобарно-изотермического процесса ДФ= =AG, где G — функция Гиббса или свободная энтальпия. Можно показать, что максимальная полезная работа L в системах с двумя постоянными параметрами равна изменению характеристической функции. Таким образом, для изобарно-изотермической системы
AG=—L.
Функция Гиббса связана с энтальпией Н, температурой Т и энтропией S:
G—H—TS.
Отсюда (при p=const, T=const)
AG = AH—TAS. (2.1)
АН — называют тепловым эффектом реакции QT. Величину AS можно определить как
Гд (АО)’
I дТ у
A G = AQ-T^’j = ~L. (2.2)
Величина AG связана с ЭДС Е0 простым соотношением (одна из форм закона Фарадея)
AG=—nFE0, (2.3)
где п — число электронов на реагирующую молекулу или ион; F — число Фарадея (96500 Кл/г).
Тогда
Второй член правой части равен тёплотё, пбглощаё — мой (выделяемой) при работе ТЭ (эта величина отнюдь не равна Qr). В зависимости от знака (дЕ0/дТ)р, т. е. от характера реакции, возможны три вида ТЭ:
а) работающие с выделением теплоты во внешнюю среду Д5>0, Eo^Qr/nF;
б) без выделения или поглощения теплоты (адиабатический режим) AS=0, Eo—Qt/hF;
в) с поглощением теплоты из внешней среды Д5<0, E0<QT/nF.
2.1. РАСЧЕТ КПД И ЭДС
Идеальный термический КПД ТЭ есть отношение максимальной полезной работы к тепловому эффекту реакции:
![]() (2.5)
(2.5)
После подстановки выражения (2.1) имеем
, т as /0
Ъ 1 а н • (2-6)
Рассмотрев три случая взаимодействия ТЭ с окружающей средой (выделение теплоты и ее поглощение, а также адиабатический режим), получим три возможных значения идеального КПД: тр<1; тр = 1; тр>1.
Как и для случая Е0, КПД определяется величиной
Физически значение КПД больше единицы означает использование для получения работы не только химической энергии реагентов, но и энергии окружающей среды.
Истинный КПД ТЭ зависит от ряда факторов и может быть представлен в виде
Г|=тіпітТ]сг, (2.7)
где ці — КПД по току, который отражает соответствие закону Фарадея данной реакции (неполное использование реагентов). Этот КПД равен отношению фактически полученного электричества к теоретически возможному:
гц=(/гК)ист/«К;
Ци — КПД по напряжению, который связан с необратимыми потерями в ТЭ (см. ниже) и отражает отличие
йёравновесного процесса от равновесного: тщ=£//До, где U — напряжение на ТЭ.
Предположим, что активные вещества — идеальные газы с постоянной теплоемкостью (учет отклонения от идеальности и переменности теплоемкостей не представляет принципиальных трудностей) [2.3]. Тогда, учитывая, что = #,*„ +Т, а давление и температура постоянны, имеем
QP = — + T2v<c№;); v. ~ ~ ; Vv. l =
= -ЪДТ1р,
где V, —стехиометрические коэффициенты, входящие в уравнение химической реакции между активными веществами 2v, S(—0.
Обозначим
-2л>гЯ /р = а; -Sv, c /p = fc,;
r/0
— 2v;/p = A.
Тогда
Q„/p=a + W; b=b=ARrTlp-
Подставив полученное значение QP/p в уравнение для ЭДС, получим
■ Е’^а + ьт + т^)’.
В результате интегрирования по Т (при p=const) получим
Е0=а—ЬТп T + Tf(p). (2.8)
Произвольная функция давления f(p), появившаяся при интегрировании по Т, определяется на основании
‘(w)r = V-~V* T^=ARrTlf
и, следовательно, f (p) = ARn pi р„.
г*
Таким образом, ЭДС газового ТЭ равна
Из полученного выражения для Е0 видно, что с изменением температуры Д0 проходит через максимум;
температура Т *, при которой Е0 достигает максимума, определяется из условия
 |
— b — b In Т + AR In р’р, = 0.
Термический КПД элемента с изменением температуры проходит через максимум, достигаемый при температуре Т„.ах, который определяется условием
— 2ab — b2Tmax — ah In Tmax + aAR In p/p0 = 0.
Так как отношение b/а положительно, то максимальное значение термического КПД ТЭ всегда больше единицы. Так же как и Е0, КПД ТЭ меняется в зависимости от давления монотонно (при Sv,<0 увеличивается и при 2v, X) уменьшается).
Проведенный анализ относится к случаю работы ТЭ при температуре, равной температуре окружающей среды. Поскольку это условие, вообще говоря, необязательно, рассмотрим особенности работы ТЭ, обусловленные неравенством температур ТЭ Т и окружающей среды Т.
Предположим вначале, что Т~>Т’. Тогда для того, чтобы все процессы были обратимы, необходимо, чтобы между температурами Т и Т’ действовала тепловая машина Карно, обеспечивающая обратимый перенос теплоты от ТЭ к окружающей среде (когда теплота выделяется в ТЭ) или от окружающей среды к ТЭ (в случае поглощения теплоты ТЭ).
Из условия обратимости процесса Д5*=0 имеем S2—5]—Ql>2/T’—0 и соответственно
При выводе формулы для термического КПД надо учесть работу тепловой машины, переносящей теплоту Qo6pi-2 от окружающей среды к ТЭ или обратно. Эта работа равна (Т—Т’)Т~1 (Q°6p,.2 77F).
Таким образом, общая работа
F —Qp — T (5, — S2) — Q^P Г ~r! ‘-
a термический КПД
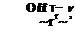 7jf = 1 — (5,—S2)
7jf = 1 — (5,—S2)
Заменив 5, — S2 через — Q°62p /V, получим, , Qf-2 t t— г, ,
ъ + Qp T’ Qp T’ + % •
где Qi-2 считается положительным, если теплота поступает от окружающей среды к ТЭ, и отрицательным, если теплота отдается ТЭ окружающей среде.
Используя (2.12), выражение для тц можно представить также в следующем виде:
^ = (2.13)
Полученные формулы для rt относятся к тому случаю, когда все процессы как в самом ТЭ, так и при теплообмене с окружающей средой обратимы.
![]()
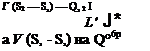 |
 |
Если процессы необратимы, то полезная работа будет меньше на V AS*, где AS*=S2—Si—Qi-2/T’, и соответственно действительный КПД ТЭ
![]()
![]() (2.15)
(2.15)
Выразив далее Q^2P jQ„ через it— 1, получим окончательно ■>]= 1 -)-QN2/Qp. Общая производимая работа
L = Qp-T(Sx — S9) + Q*p (Г — T)jV. (2.16)
Так как выражение для L’ остается для T<iT’ тем же самым, что и в случае Т>Т’, приведенные выше формулы для ці ит] имеют самое общее значение. Исследованием выражений для ЭДС и термического КПД исчерпываются результаты анализа равновесных процессов в ТЭ.
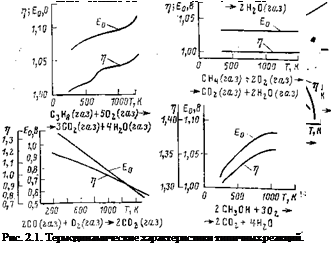 |
Результаты непосредственных расчетов ЭДС и КПД ТЭ, выполненных по приведенной методике для наибо-
лее интересных веществ, представлены на рис. 2.1. Анализ полученных соотношений, рассматриваемых в качестве каталога возможных реакций, позволяет в первом приближении оценить оптимальный температурный диапазон для выбранных исходных продуктов ТЭ.