ПЕРСПЕКТИВНІ НАПРЯМИ. ПІДВИЩЕННЯ ЕКОЛОГІЧНОЇ БЕЗПЕКИ. ЕНЕРГЕТИЧНИХ ОБ’ЄКТІВ, ЩО ВИКОРИСТОВУЮТЬ ОРГАНІЧНЕ ПАЛИВО
ПЕРСПЕКТИВНІ НАПРЯМИ. ПІДВИЩЕННЯ ЕКОЛОГІЧНОЇ БЕЗПЕКИ. ЕНЕРГЕТИЧНИХ ОБ’ЄКТІВ, ЩО ВИКОРИСТОВУЮТЬ ОРГАНІЧНЕ ПАЛИВО
8.1. Конверсія органічного палива
Органічна речовина вугілля (ОРВ) являє собою складний тривимір — ний природний сополімер, що складається з багатьох макромолекул і приєднаних до них окремих молекул. Між макромолекулами ОРВ є поперечні зв’язки, що характеризуються визначеною нестійкістю. Коли ці зв’язки руйнуються, з ОРВ екстракцією (розчиненням) можна виділити окремі молекули 70-800 а. о. м., що мають досить високу фізико-хімічну стабільність.
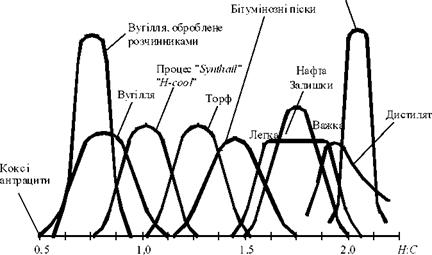
Методи конверсії твердого палива ґрунтуються на його термохімічній переробці, у результаті якої можна отримати синтетичне рідке або газоподібні паливо. Рідке паливо характеризується високим воднево — вуглецевим (5:2) відношенням (більше 1,5), водночас як для вугілля воно менше одиниці (рис. 8.1).
|
Вищі сорти палива ДВЗ
Рис. 8.1. Вплив мольного відношення 5:С на вид вуглецевої сировини |
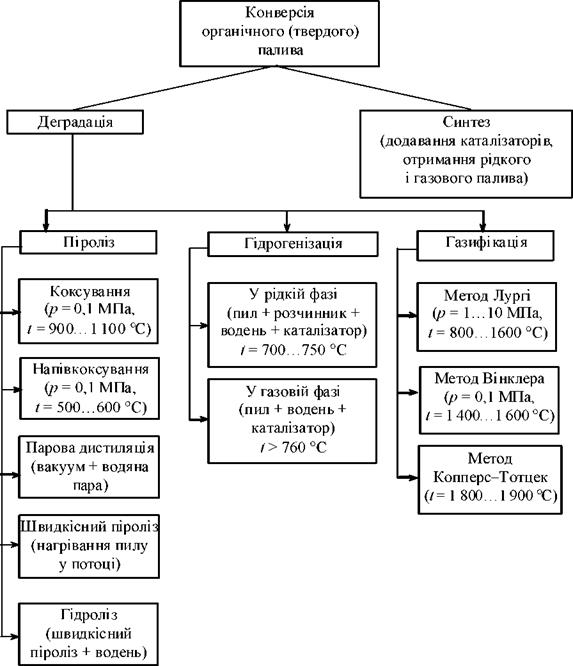
Основне завдання виробництва синтетичного палива з вугілля — збільшити вміст водню у вугільній масі. Є два принципово різні методи конверсії вугілля в синтетичне паливо: деградація і синтез, покладені в основу класифікації конверсії органічного палива, схему якої наведено на рис. 8.2.
|
Рис. 8.2. Класифікація методів конверсії твердого органічного палива |
Деградація, що підрозділяється на піроліз, гідрогенізацію і газифікацію, полягає в розкладанні молекули вугілля на окремі складові, молеку — лярна маса яких знаходиться в межах, характерних для рідких вуглеводневих продуктів.
Є два способи збільшення воднево-вуглецевого відношення — перерозподіл водню у вугіллі і додавання водню ззовні. У першому випадку в результаті перерозподілу водню поряд з рідкими продуктами утворюється карбонізований залишок (напівкокс, кокс), що можна використовувати як паливо або піддати його подальшій переробці кисневою або паровою газифікацією. Такий процес називають піроліз вугілля, він полягає в нагріванні вугілля в інертному середовищі. Коли вугілля нагрівається до 400 °С і вище, у макромолекулі починають відбуватися реакції розриву зв’язків.
Залежно від температурного рівня процесу піролізу органічної маси вугілля розрізняють: коксування (процес прир ~ 1 атм в інтервалі температур t = 900…1 100 °С), напівкоксування (при t = 500…600 оС), парову дистиляцію (процес у вакуумі з додаванням водяної пари, у результаті чого збільшується вихід летких), швидкісний піроліз (піроліз вугільного пилу в потоці зі швидкістю нагрівання часток 104 К/с), гідропіроліз (швидкісний піроліз з додаванням водню).
Процес гідрогенізації може відбуватися як у рідкій, так і в газовій фазі. Під час рідкої гідрогенізації вугільна паста, що складається з вугільного пилу і розчинника, підігрівається до температури 700…750 оС при високому тиску за наявності водню. У цій технології застосовують також каталізатори.
Газофазна гідрогенізація відбувається без носія (розчинника) при вищій температурі (t > 760 оС) і нижчому тиску.
Під час газифікації вугілля утвориться синтез-газ (суміш СО і Н2О у відповідній пропорції) або метан.
У сучасній промисловості застосовують три основні методи газифікації: метод Лургі (газифікація в нерухомому шарі при t = 800…1 600 °С, тиску 1,0…10,0 МПа і розмірі частинок вугілля 8 = 3…30 мк), метод Вінклера (у супутному потоці при атмосферному тиску і t = 1 400… 1 600 °С), метод Копперс — Тотцек (у псевдозрідженому шаріпри t = 1 800. 1900 °С).
Якщо розглядати вугілля як чистий вуглець, то газифікацію можна описати за допомогою реакцій:
С + 2Н2 О = СО2 + 2Н2 + 90 кДж/моль;
С + / О2 = СО — 111 кДж/моль; (8.1)
С + Н2О = СО + Н2 — 131 кДж/моль.
Перша реакція перебігає з поглинанням (знак «+»), а дві останні — з виділенням теплоти (знак «-»). Щоб одержати синтез-газ (суміш СО і Н2 визна
ченого складу), переважно використовують так звану парокисневу газифікацію, проводячи одночасно першу і другу реакції з системи рівнянь (8.1), підбираючи таке співвідношення між Н2О і 02, щоб сумарний процес був автотермічним, тобто не потрібно було підводити чи відводити теплоту.
Процес синтезу водневих сполук із синтез-газу в спрощеному вигляді можна подати як одну з таких реакцій:
![]() nCO + 2nH2 = (CH2) n + nH2O; 2nCO + nH2 = (CH2) n + nCO2.
nCO + 2nH2 = (CH2) n + nH2O; 2nCO + nH2 = (CH2) n + nCO2.
Для першої реакції (8.2) мольне відношення Н:С0 має дорівнювати 2:1, для другої — 1:2.
Зазвичай реакції синтезу на вигляд складніші, і шлях процесу залежить від каталізаторів, що при цьому застосовують. У результаті реакцій синтезу з вугілля можна одержати як рідке, так і газоподібні паливо, зокрема замінники природного газу, що переважно містять метан.
Технології конверсії твердого палива можна застосовувати для переробки різноманітного асортименту сировини, зокрема відходів деревини, сільськогосподарські та тверді міські відходи, водорості.