КОРРОЗИЯ. МЕТОДЫ ЗАЩИТЫ МЕТАЛЛА ОТ КОРРОЗИИ
КОРРОЗИЯ. МЕТОДЫ ЗАЩИТЫ МЕТАЛЛА ОТ КОРРОЗИИ
Коррозией называют самопроизвольное разрушение металлов вследствие физико-химического взаимодействия их с окружающей средой. В практике водоснабжения под материалами подразумеваются простые металлы, а также оборудование и изделия, которые изготовлены из этих металлов; средой, в которой происходит коррозия металлов, является вода. Следовательно, процессы коррозии связаны с характерными особенностями воды и металла. Однако коррозию следует отличать от эррозии — поверхностного механического разрушения металлов.
Характер и причины коррозии теплообменных аппаратов, трубопроводов и сооружений. Известно, что коррозионный процесс протекает на границе двух фаз: металл — окружающая среда, т. е. является гетерогенным (неоднородным) процессом взаимодействия жидкой или газообразной среды (или их окислительных компонентов) с металлом. Причины и характеры коррозионных процессов весьма разнообразны: атмосферная и почвенная электрохимическая коррозия: электрохимическая коррозия при контакте металлов с разными значениями электрохимического потенциала; химическая коррозия о жидких (высокосермистыс нефти) и газовых средах; электрокоррозия объектов, связанных с электроустановками большой мощности; электрохимическая коррозия в растворах кислот, щелочей, мицеллярных растворов; биокоррозия в присутствии продуктов жизнедеятельности сульфатвосстанавливающих бактерий.
В практике водоснабжения распространена электрохимическая коррозия, происходящая в присутствии электролитически проводящей среды, при которой ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла.
В практике водоснабжения наблюдается и электрокоррозия, или коррозия под действием так называемых блуждающих токов.
По условиям протекания коррозия в системах водоснабжения представляет в основном электрохимический окислительно-восстановительный процесс, возможность протекания которого определяется изменением свободной энер-
гии системы. Анодный процесс связан с переходом ионов металла в раствор; при катодном процессе происходит ассимиляция электронов содержащимся в растворе деполяризатором (растворенный кислород — кислородная деполяризация, ионы водорода — водородная деполяризация). На одном и том же участке металлической поверхности могут происходить одновременно анодный и катодный процессы.
Нередким случаем в системах оборотного водоснабжения является биологическая коррозия при участии продуктов, выделяемых микроорганизмами биологических обрастастаний.
В отдельных случаях происходит коррозия при трении (коррозионная эрозия) разрушение металла, вызываемое одновременным воздействием коррозионной среды и трением (например, разрушение шейки валков прокатных станков, охлазвдаемых морской водой).
По характеру коррозионного разрушения различают следующие виды коррозии:
• сплошная или общая коррозия, охватывающая всю поверхность металла, находящуюся под воздействием данной коррозионной среды (воды). Сплошная коррозия бывает равномерной и неравномерной. Равномерная коррозия протекает примерно с одинаковой скоростью по всей поверхности металла, неравномерная с неодинаковой скоростью на различных участках поверхности металла (что чаще наблюдается при использовании для водоснабжения морской воды);
• местная коррозия охватывает лишь некоторые участки в виде отдельных пятен и язв или отдельных точек диаметром 0,1-2 мм (что чаще наблюдается на хромоникелевой нержавеющей стали). Местная коррозия может быть также сквозной и подповерхностной.
Сущность электрохимической коррозии состоит в следующем. Если два разных металла поместить в электролит; то создается гальванический элемент. При этом один металл будет анодом, а другой катодом. Анод будет посылать свои атомы в раствор, и разрушаться, а на катоде будут выделяться атомы вытесняемого из раствора элемента.
То же будет происходить, если поместить железо в воду. Вода является электролитом, анодом же и катодом будет само железо; вернее," на железе одни участки станут анодом, а другие катодом. Объясняется это тем, что в практике не существует однородных металлов. Некоторая разница в структуре отдельных участков металла, в закалке, наличии окалины, царапины, вмятины и т. д. приведут к тому; что часть одного н того же материала (например, трубы) станет анодной, а другая — катодной и образуется гальванический элемент. В большинстве случаев это микроэлементы.
Скорость коррозии пропорциональна силе тока, проходящего между двумя металлами (точнее, двумя участками одного и того же металла), которая по закону Ома равна:
|
|
(3.2))
где Е — разность потенциалов катода Еу и анода RA — внутреннее сопротивление, т. е. сопротивление жидкой фазы (воды); R,.— внешнее сопротивление, т. е. сопротивление металла.
Посылая свои атомы в воду, железо вытесняет из нее водород, который выделяется на катоде, образуя, окисную плеику. Эта пленка тормозит реакцию и могла бы ее вовсе прекратить, если бы не ряд обстоятельств, которые обычно этому мешают. Наличие окисной пленки на металле сдвигает его потенциал в положительную сторону, следовательно, металл, покрытый окисной пленкой, будет мало разъедаться, пока эта пленка сохраняется, и тем меньше, чем окисная пленка плотнее.
При электрохимической коррозии стали внутреннее сопротивление R4 значительно больше внешнего RB, и от его величины в большой мере зависит сила тока, а, следовательно, и скорость коррозии. Внутреннее сопротивление, т. е. сопротивление жидкой фазы, имеет наибольшее значение, когда ею является чистая вода. В чистой и с малым содержанием растворенных солей воде электрохимическая коррозия идет очень медленно, но если вода содержит хотя бы незначительное количество растворенных солеи и газов (как С02, S02), ее электропроводность сильно повышается (т. е. уменьшается величина R4), соответственно возрастает сила тока и коррозия металла в этой воде. В морской воде, имеющей высокую электропроводность, металлы больше подвергаются коррозии. Электропроводность морской воды повышается вследствие содержания в воде магниевых солей:
|
(3.22) |
Mg2+ + 2СГ + 2НгО = Mg(OH)2 + 2Н+ + 2СГ.
При коррозии металлов в воде выделение водорода обычно не происходит: у менее активных участков металла ионы водорода присоединяют электроны и Одновременно соединяются с кислородом, растворенным в воде:
|
(3.23) |
4Н1 + 4е + 02 = 2Н20.
Кислород сильно увеличивает коррозию металлов в воде. Особенно его присутствие опасно в воде систем оборотного водоснабжения.
Изменение разности потенциалов Ек-Ес называется поляризацией коррозионного элемента: смещение потенциала анода в положительную сторону при
прохождении анодного тока — анодная поляризация; смещение потенциала катода в отрицательную сторону при прохождении катодного тока — катодная поляризация.
Вещества, препятствующие процессу поляризации, называются деполяризаторами.
Сущность явления поляризации сводится к тому, что электроны перемещаются быстрее, чем протекают электродные реакции. Физически это можно представить так, что при своем движении в раствор атомы металла захватывают положительно заряженные ионы, на металле остаются отрицательно заряженные ионы. Поэтому между металлом и растворам возникает электростатическая сила, препятствующая коррозии. С течением времени раствор все более и более насыщается положительно заряженными ионами, электростатическая сила возрастает, коррозия замедляется и, наконец, прекращается. Наступает так называемая поляризация. Обычно поляризация тормозит работу локального элемента и уменьшает скорость электрохимической коррозии.
акторы, влияющие на скорость электрохимической коррозии стали. Существует ряд факторов, ускоряющих или замедляющих коррозию металлических труб и аппаратов.
Влияние величины pH общеизвестно: считается, что с увеличением pH среды, при прочих равных условиях, коррозия уменьшается, и, наоборот — с понижением pH иона увеличивается. Значение pH минимальной коррозии будет характерной величиной для каждого металла:
Мешш…………… AI……….. Pb Sn Zn Fe
РН………………………….. 6,5……………… 8 8,5 11,5 14
В зоне нейтральных значений pH (от 4 до 9) коррозия стали почти не зависит от ее величины, так как растворимость и скорость диффузии кислорода существенно изменяются с изменением величины pH. Снижение скорости коррозии стали при дальнейшем увеличении pH (от 10 до 14) объясняется главным образом уменьшением растворимости продуктов коррозии в щелочах (образование гидратов).
Практически отмечается, что коррозия происходит и при pH = 7ч-7,2 с рыхлыми отложениями. При pH > 7,5 продукты коррозии становятся прочными, защищающими металл от разрушения.
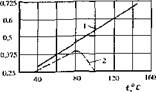
Влияние температуры на скорость коррозии стали не одинаковое. В закрытой системе оборотного водоснабжения с увеличением температуры воды коррозия увеличивается. Это объясняется торможением свободного выделения кислорода из воды. Кривые, характеризующие зависимость коррозии от температуры, близки к прямой линии (рис. 3.9, кривая I).
В открытой системе оборотного водоснабжения при температуре воды выше 70-80 °С (кривая 2) происходит снижение коррозии вследствие сильного уменьшения растворимости кислорода с повышением темпераіурьі.
Растворимость кислорода в воде изменяется в зависимости от ее температуры для одного и того же парциального давления: при О °С содержание О в воде равно 20 см3/л (14,16 мг/дм3), при 20 °С —
около 6 см3/л (8,84 мг/дм ); при 40 °С — около 4,2 см3/л (6,59 мг/дм3); при
60 °С— около 3,15 см3/дм3; при 80 °С — около 2,2 см3/дм3; при 100 °С — 0.
Кислород в отношении коррозии играет двоякую роль: он может быть и усилителем и замедлителем. Коррозия увеличивается почти пропорционально изменению содержания кислорода в воде. При этом реакции протекают, например, согласно следующим уравнениям: анодный процесс
Fe -> Fe2+ 2е“, (3.24)
катодный процесс
•^02 + 2е~ + Н20 -» 2(ОН“ ). (3.25)
Кислород необходим для образования защитных пленок. Он в состоянии разрушать водородную пленку на катоде и образует в воде ионы ОН~. Эти ионы являются положительным электродом, который влечет к себе положительные заряды из металла. Указанная выше реакция называется процессом с кислородной деполяризацией.
|
Ск, мн/год
|
Однако в естественных водах (щелочных и нейтральных) кислород оказывает влияние на плотность образующейся защитной пленки: при малом содержании кислорода пленка получается рыхлой, плохо пристающей; при большой концентрации кислорода пленка получается плотной, хорошо пристающей, благодаря чему коррозия может прекратиться или замедлиться. По опытам многих авторов при pH = 6-^8 и росте количества кислорода в воде до 14
Рис. 3.9. Зависимость скорости коррозии (С., мм/ Г0Д) Стали в воде о г температуры °С: / ■—закрытая система; 2 — открытая система
|
] |
этим препятствует образованию защитной пленки. ^ ко-педаых
Хлориды являются ускорителями коррозии по двум причинам. ^ BVUial0. вследствие увеличения кислотности воды; во-вторых, вследствие разр Щего действия, оказываемого хлорид-ионом на защитную пленку.
Сульфаты влияют на коррозию металла при карбонатной жесткості 2 мг-экв/дм3 незначительно, но оказывают агрессивное воздействие на При содержании сульфатов до 300 мг/л вода считается слабоагрессквда,^ 600 мг/дм1) —■ средней агрессивности и свыше 600 мг/дм сильно агре
ной, а более 1200-1500 мг/дм3 очень сильно агрессивной. еталла
Нитраты уже при небольших концентрациях вызывают окисление м ^ что способствует образованию на железе защитной пленки — С точки зре коррозии содержание нитратов до 20 мг/дм не опасно.
Кислоты ускоряют процесс коррозии, так как являются деполяризаторал Сероводород усиливает коррозию. Он в состоянии вызывать коррозию држе отсутствие кислорода, образуя элементарную серу и сульфид железа, ко горы будут катодом в отношении основного металла. В присутствии кислорода се
|
СО* мг/л
0,1 0,2 0,3 0,4 0,5 С„ гД. м5-ч) ^*tc. 3.10. Зависимость скорости коррозии углеродистой стали or концентрации свободной углекислоты в воде 0 |
роводород образует сернистую и серную кислоты, которые являются деполяризаторами.
Увеличение скорости движения воды ускоряет коррозию поверхности омываемого металла. При отсутствии движения воды коррозионный процесс происходит между поверхностью металла и прилежащими слоями воды, поэтому быстро наступает поляризация. При движении в реакцию вовлекаются новые слои воды, увеличивается приток кислорода и коррозия усиливается.
Осадки независимо от их природы способствуют быстрому развитию локальной коррозии. Образовавшиеся из механических примесей, карбонатных или других, отложения вызывают местный перегрев металла и быстрое его разрушение.
Биологические обрастания всегда связаны с осаждением механических примесей, поэтому они также вызывают локальные коррозионные элементы и стимулируют развитие точечной (пиггинговой) коррозии. В отдельных случаях могут развиваться сульфатвосстанавливаюіцие бактерии, вырабатывающие H2S, которыми вызывается также точечная коррозия. В отдельных случаях могут развиваться железобактерии (при содержании в воде железа не менее 0,2 мг/ дм ), которые переводят закисное железо Fe(OH)2 в окисное Fe(OH)3.
Степень коррозионной стойкости материала принято характеризовать скоростью коррозии его при действии агрессивной среды (воды). Коррозионная стойкость металлов при равномерной коррозии и стационарном процессе определяется скоростью коррозии в г/м2-ч или мм/год. Коррозионная стойкость неметаллических материалов оценивается качественно по изменению прочности, проницаемости и других свойств материалов.
Оценку степени агрессивного воздействия среды (воды) на незащищенные металлы и неметаллические материалы следует производить по данным испытаний их образцов и показателям, приведенным в табл.3.18 и 3.19.
Испытания образцов материала проводятся в лабораторных или натурных условиях, с экспозицией в воде не менее 800 ч.
Отметим, что в настоящее время имеется значительное количество компактных приборов, которые практически мгновенно определяют степень агрессивности воды (CILIA, Япония и др.). Ими следует пользоваться.
Методы защиты металла от коррозии. При проектировании систем оборотного водоснабжения с вынужденным применением агрессивной (по отношению к металлу и бетону) воды следует, прежде всего, выбирать стойкие материалы для оборудования, трубопроводов и сооружений, предусматривать их защиту покрытиями или соответствующую обработку воды. Обеспечение коррозионной стойкости производственных аппаратов и другого оборудования должно предусматриваться в технологических проектах производства с учетом степени агрессивности воды.
|
Таблица 3.18 ДЕСЯТИБАЛЛЬНАЯ ШКАЛА КОРРОЗИОННОЙ СТОЙКОСТИ МЕТАЛЛОВ В ВОДЕ
|
|
Табл и ца3.19 ОЦЕНКА СТЕПЕНИ АГРЕССИВНОГО ВОЗДЕЙСТВИЯ ВОДЫ НА НЕМЕТАЛЛИЧЕСКИЕ МАТЕРИАЛЫ ПО ВНЕШНИМ ПРИЗНАКАМ
|
Защита металла от коррозии может быть осуществлена многими способами. Выбор того или иного из них в каждом отдельном случае должен основываться, прежде всего, на знании причин возникновения коррозии, ее формы и т. д. При этом необходимо согласовать следующие требования: 1) эффективность защиты; 2) сохранение металлом всех требуемых от него механических свойств; 3) зашита должна быть, возможно, более дешевой.
Основными традиционными методами защиты металлов от электрохимической коррозии в системах оборотного водоснабжения являются следующие.
Обработка коррозионной среды, представляющая собой в основном нейтрализацию кислых сточных вод (например, в системах оборота промывных вод при травлении металла в кислоте). К этому методу может быть отнесено так же обескислороживание воды, но оно в системах оборотного водоснабжения не применяется.
Обработка воды замедлителями коррозии с образованием защитных окис — ных и других неметаллических пленок неорганическими и органическими:
а) к неорганическим замедлителям коррозии относятся нитрат натрия NaNOr хромат калия К2СЮ, и биохромат калия К, Сг207, силикат натрия Na2SiO,, фосфаты (гексаметафосфат натрия, триполифосфат натрия и динатрийфосфат), ИОМС и др.
б) к органическим замедлителям коррозии относятся глюкозаты хрома, супь — фогпюкозаты хрома сульфоглюкозаты натрия и др. Защитные покрытия поверхности металлами, пластиком, лаками, красками, смолами, эмалями, эпоксидными составами.
Электрохимическая протекторная защита лгешалла. Применение того или иного метода должно основываться на исследованиях как скорости коррозии металла без применения его защиты, так и эффективности защиты.
Применение любого вида защиты осуществляется после проведения необходимых исследований, осуществляемых в лабораторных или натурных (промышленных, природных) условиях. Методы исследований давно и хорошо известны.
Наиболее дешевой защитной плеикой является самостоятельно образовавшаяся так называемая карбонатная пленка, которая состоит преимущественно из окислов железа (50-70 %) и карбоната кальция (10-20 %), остальное — главным образом кремниевая кислота. Такая тонкая пленка, хорошо прилегающая к поверхности металла, хорошо его защищает от коррозии. Однако толщина этой плеики не должна быть больше 0,5 мм во избежание уменьшения теплопередачи стенки аппарата от охлаждаемого продукта в воде.
Карбонатную пленку регулируемой толщины следует создавать путем выбора соответствующего размера освежения оборотной воды (продувки системы) или обработки добавочной воды известью (известковым молоком) или известью и содой.
Выделение карбонатной пленки на чистую теплообменную поверхность и стенки трубопроводов с образованием плотной защитной пленки может происходить при карбонатной жесткости оборотной воды не менее 1,5—2 мг-экв/ дм, наличии в воде Са2+ и содержании СГне более 50 мг/дм, при отсутствии или весьма малом сбросе воды из системы оборотного водоснабжения. При большей карбонатной жесткости воды содержание С1 в ней может быть допущено до 100 мг/дм3 и более.
Образуемая карбонатная пленка может и не обеспечивать надежную защиту металла от коррозии, однако ее присутствие сводит к минимуму потребное количество других ингибиторов (замедлителей коррозии).
Ингибиторами, по своей природе бывают ионными или молекулярными соединениями. Они адсорбируются на поверхности корродирующего металла электрохимически или химически; возможна также адсорбция их вследствие
одновременного действия разных сил. Адсорбируясь на поверхности корродирующего металла, замедлители тормозят протекание анодного или катодного процесса электрохимической коррозии, или, образуя экранирующую пленку, изолируют металл от электролита, или имеют смешанный характер замедляющего действия.
К анодным замедлителям электрохимической коррозии металлов относятся кислород, нитриты, хроматы и др., которые, пассивируя металл, затрудняют протекание анодного процесса, т. е. замедляют коррозию.
При недостаточной концентрации анодных замедлителей для наступления полной пассивации металла (особенно в присутствии депассивирующих ионов, например ионов С Г) они являются опасными, так как могут вызвать ускорение общей или местной коррозии, действуя как катодные деполяризаторы.
К катодным замедлителям электрохимической коррозии относятся вещества, превышающие перенапряжение катодного процесса при их адсорбции на катодных участках поверхности корродирующего металла: соли или окислы мышьяка и висмута, желатина и другие органические вещества. При недостаточной концентрации в воде они не вызывают усиления коррозии.
|
(3.2 6) (3.27) |
К экранирующим замедлителям электрохимической коррозии металлов относятся вещества, адсорбирующиеся на металле и образующие хемосорбци — онный слой или чаще защитную пленку нерастворимых продуктов, взаимодействуя с первичными анодными продуктами коррозии — ионами растворяющегося металла (NaOH и Na2C03 образуют гидроокиси черных металлов, фосфаты, полифосфаты и бензоаты — фосфаты и бензоаты железа, Na^SiO, силикаты железа и алюминия) или с первичными катодными продуктами ■ гидроксильными ионами при кислородной деполяризации:
Са (НС03)2 +ОН~= СаС03+ НС0’3 + Н20; ZnS04+ 201-Г = Zn(0%fS0/
К смешанным замедлителям электрохимической коррозии металлов относятся вещества, тормозящие протекание обоих электродных процессов.
Эффект действия замедлителей коррозии металлов принято характеризовать величиной защитного действия
|
(3.28) |
ЗЭ——100%
где С. и С, — скорость коррозии металла без замедлителя и с замедлителем в г/(м2-ч).
Конкретизируя практику использования антикоррозийной защиты, вернемся к следующим методам стабилизационной обработки воды при отрицательном значении индекса насыщения J;
• реагентный с применением извести, соды, щелочи;
• фильтрационный с применением мраморной крошки или магномассы;
• удаление агрессивных газов;
• замедлители коррозии.
Сущность методов и уравнения реакций представлены в табл. 3.20.
Реагентную обработку агрессивной воды проводят в два этапа: в начальный период путем введения в воду реагента с расчетной дозой (Дш1) обеспечивают наращивание на внутренних стенках труб защитной карбонатной пленки, при этом создают У, ~ +0,7; после формирования защитной пленки обработка воды с целью сохранения ведется дозами реагента (Д1и2) при условии поддеркания
Л~°-
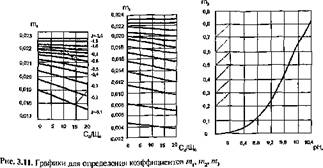
Расчет требуемой дозы подщелачивающего реагента для каждого конкретного случая производится по табл. 3.21. Коэффициенты /и,, mv m3 определяются по i-рафикам рис. 3.11, коэффициен т (3 — рис. 3.12, коэффициенты % и £ — рис. 3.13.
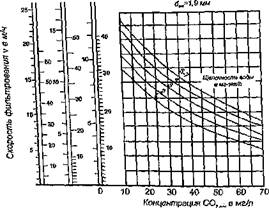
Фильтрационный метод. Скорость фильтрования через магномассу зависит от толщины слоя загрузки, температуры и щелочности воды. Для определения скорости фильтрования удобно воспользоваться графиками (рис. 3.14).
Скорость фильтрования, м/ч, определяемая по графикам на рис. 3.14 может быть откорректирована
1,9 Ы
У^ТТТ’ <3-29>
uwn "rp гр
|
|
|
Таблица 3.20 МЕТОДЫ СТАБИЛИЗАЦИОННОЙ ОБРАБОТКИ ВОДЫ____________________________
|
|
Таблица 3,21 ОПРЕДЕЛЕНИЕ ДОЗЫ РЕАГЕДТОВ ДЛЯ СТАБИЛИЗАЦИИ ВОДЫ_________________________
|
|
|
|
0,1 0,09 0,08 0,07 о. оа 0,05 QJ04 0,03 |
|
0,02 |
|
0/)1 0.009 олоз 0.007 сдое 0.005 0.004 одоз |
|
0,002 |
|
0дх>1 |
|
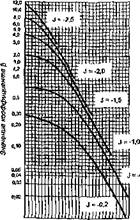
5.0 S.5 6.0 6,8 по 7,5 6.0 ВА 9.0 W W рН„ pH, Рис. 3.13. График для определения коэффициента с и х при стабилизационной обработке воды подше — лачиванием (при рН0 <8,4 <.pHs) |
|
5 5Д 6 в.5 7 T, S О pH воды Рис. 3.12. График для определения коэффициента р при стабилизационной обработке воды подщелачиванием (при рНс<рНл<8%4) |
где — — скорость, высота слоя и температура, определяемые по графи
ку на рис. 3.14; d h, I — эквивалентный диаметр, высота слоя и температура для расчетного случая.
Удаление агрессивных газов. Растворенные газы, такие как кислород, углекислота, сероводород, значительно увеличивают коррозионную активность воды.
Растворенные газы удаляются химическими и физическими методами. Кислород удаляется реагентным методом применением сульфита натрия, гидразин — гидрата, топочных газов. Кислород связывается железом при фильтрации в стальной стружке.
Углекислота нейтрализуется щелочными реагентами применением каустической соды или извести.
Сероводород извлекается применением окислителей: озон, хлор, перманганат калия, перекись водорода.
Физические методы предусматривают аэрацию воды пропусканием в пленочных и барботажных дегазаторах либо вакуумирование воды с помощью вакуумных насосов и эжекторов.
|
Лсл = 2,2 м 1,6 м 1,2м t=lZC 651 1? 65е *2° 65*С |
|
Рис. ЗЛ4. График для определения скорости филирования |
Из современных ингибиторов коррозии положительные результаты получены при использовании нефтяниками ингибитора комплексного действия ХПКС — 10 (Когалымский завод химреактавов) в количестве 50 мг/дм3 воды.
Сравнительный анализ применения ингибитора ХПКС-10 и совместного применения ингибиторов коррозии ХПК-002 (М)Ф и солеотложения ХПС-001 по результатам лабораторных исследовании показывает, что последний вариант совместного применения ингибиторов предпочтительнее, чем использование ингибитора комплексного действия, т. к. по антикоррозионной защите эффек — тавность в обоих случаях составила 40 %, а по ингибированию отложения солей 75,9 % по сравнению с 60 %. В ТПП «Урашефгегаз» освоено промышленное использование ингибиторов коррозии. Технико-экономические показатели применения ингибиторов приведены в табл. 3 22 Защитные покрытия на поверхностях, ко. пакгиру. ощих с водой. Отметим. что металлические и полимерные покрытия, и особенно гальванические, достаточно редко используются для защиты металлоизделий, используемых в водохозяйственных комплексах. Для этого используют значительный ассортимент красок, лаков, смол, эмалей, эпоксидных и других композиций.
|
Таблица 3.22 ТЕХНИКО-ЭКОНОМИЧЕСКИЕ ПОКАЗАТЕЛИ ИНГИБИТОРОВ КОРРОЗИИ
|
Каждое из применяемых покрытий должно отвечать следующим требованиям: создавать барьер проницаемости по отношению к воде, кислороду и агрессивным хлор-ионам; тормозить протекание коррозионного процесса; обеспечивать длительный срок службы.
Для получения «долговечных» покрытий и экологии основного материала, защищаемую поверхность предварительно тщательно очищают от продуктов коррозии, пленок, загрязнений и др, механическими (песко — и дробеструйная обработка и др.), химическими (травление, декапир, обезжиривание и др.) и комбинированными способами. При необходимости очищенную поверхность грунтуют (например, фосфатированием) для улучшения качества покрытия и сцепления (адгезии) его с поверхностью металлоизделий.
В качестве примера можно привести современные экономичные покрытия для металлоемких и крупногабаритных (магистральные водоводы, металлические емкости и др.) сооружений водохозяйственного назначения на основе лакокрасочных материалов (J1KM), разработанных и внедренных сотрудниками Северо-Казахстанского госуниверситета (г. Петропавловск, Республика Казахстан). Лучшие результаты при работе в слабоагрессивной (оборотная вода) среде показали два вида J1KM на основе олифы и битума (растворитель —Уайт-спирит) с наполнителями (пигментами) алюминиевой пудрой или свинцовым суриком в присутствии диспергирующей и смачивающей добавки ПАВ АС-1 в количестве от 2 до 5 % по массе. Для агрессивных сред (производственные стоки) предложена каучуко-смоляная композиция на основе битумных и алкилфенсшформальдегидных пленкообразующих, порошковых органических (каучук) и неорганических (пигмент-ашоминиевая пудра) наполнителей с добавкой ПАВ АС-1 в тех же количествах. При этом значительно улучшаются (на 3-4 балла) показатели антикоррозионной защиты, уменьшается в 2,5 раза водопоглащение покрытий и повышается их солестойкость, сокращается (до 40 %) расход пигментов, в 2 раза улучшается укрывистость, повышается па 40 % твердость и на 30 % — адгезия.
Также следует остановиться на электрохимической защите металлоизделий в системах водного хозяйства. Данный способ зашиты металла от коррозии (называемый также катодным протекторным) основан на том, что в воде, омывающей металл, который может подвергаться коррозии, создается электрическая пара, в которой защищаемый металл играет роль катода, а другой металлический электрод, помещенный в ту же воду и соединенный с ним электрически, — роль растворяющегося анода. Электрическая пара может образовываться как за счет’ естественной разности потенциалов, так и путем наложения постоянного тока от постороннего источника. В первом случае второй металл должен обладать более низким, чем первый, потенциалом растворения (для защиты железа можно применять цинк и алюминий). Во втором случае для усиления эффекта защиты используется источник постоянного тока, к отрицательному полюсу которого присоединяется защищаемый металл (становящийся катодом), к положительному — куски металла (в данном случае это может быть тот же металл), образующие анод.
В заключении следует напомнить, что необходимо наладить контроль за коррозией и эффектом защиты трех видов: лабораторный, внелабораторный и эксплуатационный. Совместная оценка всех трех видов контроля позволяет сделать надлежащие выводы и определить необходимые меры.
К сожалению, последние годы практически все работы, связанные с защитой от коррозии, ведутся совершенно недостаточно.
Биологические обрастания и методы борьбы с ними. В воде открытых водоемов находятся самые различные живые существа (от бактерий до оболочников), которые поселяются на любой твердой поверхности, соприкасающейся с водой. Многие из них (зрелые растения, животные или их личинки) проникают в трубопроводы, резервуары, теплообменные аппараты и т. п., где и развиваются. Такие поселения называют обрастаниями, а организмы — био — гентами.
Физические особенности, химический состав и биологические свойства этих организмов бывают самыми разнообразными и во многом зависят от условий среды. Средства борьбы с обрастаниями могуг быть также различными.
В системах оборотного водоснабжения биологические обрастания представляют собой совокупность микроорганизмов, поселившихся и развивающихся на теплообменной поверхности аппаратов в трубопроводах и на конструкциях охладителей оборотной воды. Эти обрастания образуются вследствие заноса микроорганизмов с водой из источника и наличия благоприятных условий для их размножения в системе оборотного водоснабжения: повышение температуры до 15-40 °С, присутствие в воде питательных веществ и растворенного кислорода.
При температуре свыше 42 °С большинство организмов обрастаний развиваться не может.
Основные организмы обрастаний в теплообменных аппаратах (1), градирнях и брызгальных бассейнах (II) следующие:
Бактерии
Зооглейные — Zooglca ramigera, Zooglea uva и др.. + +
Нитчатые — Sphaerotilus dichotomus……………….. +………………… +
Железобактерии — Leptothrix ochracea,
Crenothrix polispora, Gallionella ferricjimca………… +
Серные — Beggiatoa alba……………………………… +
Водоросли
Диатомовые (Diatomea) — Cyclotella, Melosira,
Navicula, Kitscia и др……………………………………. -………………… +
Зеленые (Chlorophycca) — Cladophora,
Sti-geoclonium, Scenedesmus, Pedlastrum и др…….. -………………… +
Сине-зеленые (Cyanophycea) — Osceillatoria,
Phormidium, Microcystis……………………………….. -………………… +
Простейшие Инфузории (Jnfusoria) — Paramecium cadatum,
Vorticella, Carchesium и др……………………………. +………………… +
Корненожки (Rhizopodia) — Arcella vulgaris,
Difflugia pyriformis……………………………………… +………………… +
Черв и — Nematodes, Oligocheta…………………….. +………………… +
Коловратки — Philodina, Rotaria и др…………….. +………………… +
Грибы…………………………………………………….. +………………… +
Детрит…………………………………………………… +………………… +
Примечание. Знак (1) показывает наличие этих организмов, а (-) — отсутствие.
В закрытых теплообменных аппаратах неогневого нагрева и в трубопроводах преобладающими формами биологических обрастаний являются пивным образом зооглейные, а часто (когда вода загрязнена фекалиями) и нитчатые бактерии. Среди них имеются инфузории, а также другие простейшие и черви; обрастания иногда могуг состоять из водных грибков. Попадающие в охлажденную воду (через возможные неплотности в аппаратах) с продуктом или со стоками биогенные элементы (ушерод, азот, сера, железо, фосфор и др.) усиливают процесс развития микроорганизмов в теплообменных аппаратах. Например, при более высокой концентрации в веде серы или железа интенсивнее развиваются серобактерии или железобактерии.
В отдельных случаях в теплообмениых аппаратах наблюдаются поселения мшанки, для которых температура 45-50 °С не оказывает губительного влияния. Мшанки служат убежищем для всякого рода симбионтов (сожителей) и очагом для развития бактерий. Иногда встречаются также грибные обрастания, состоящие из сплетении ветвящихся нитей (гифов) и образующие мицелии.
В холодильниках огневого нагрева (например, фурмы доменных печей, кессоны и пятовые балки мартеновских печей, глисажные трубы нагревательных печей прокатных станов), іде вода кипит непосредственно у стенки холодильника, гидробиологические обрастания отсутствуют.
На градирнях и в брызгальных бассейнах, а также на оросительных холодильниках биологические обрастания состоят как из бактерий, — гак и из водорослей. Водоросли развиваются на освещенных, омываемых водой поверхностях: сине-зеленые и зеленые — в теплое время года; диатомовые — весной и осенью, а иногда и зимой. В составе обрастаний на градирнях и в аппаратах встречаются также инфузории, черви, моллюски и др.
В закрытых теплообменных аппаратах и трубах в составе обрастаний могут быть занесенные водой с градирен водоросли, а также механические минеральные примеси (осадок) и гидрат окиси железа. Механические минеральные примеси и железо обнаруживаются и в обрастаниях градирен, брызгал ь — ных бассейнов, оросительных холодильников и резервуаров. Если в охлажденной оборотной воде содержатся нефтепродукты, то и они прилипают к последним по мере их образования.
Качественный и количественный состав и интенсивность биологических обрастаний зависят от физических и химических свойств воды, а также условии ее использования.
Для развития микроорганизмов необходимы следующие девять элементов: органогены — углерод С, водород Н, кислород О, азот N, элементы золы — фосфор Р, калий К, сера S, магний Mg, железо Fe. Каждый из этих элементов должен находиться в удобоусвояемом для данного микроорганизма соединении.
Бактерии являются основным компонентом обрастаний. Процесс обрастания начинается с бактериальной пленки, первыми появляются студенистые массы зооппейных бактерий, в последующем — простейшие нитчатые бактерии и др. Вслед за ними в обрастании развиваются инфузории одноклеточные и колониальные, а на открытых поверхностях — и водоросли, затем черви и др.
Методы борьбы с биологическими обрастаниями обычно предусматривают использование ядовитых для них веществ, не влияющих на здоровье обслуживающего персонала, безвредных для оборудования и сооружений систем водного хозяйства. В практике достаточно давно для этих целей используют хлор и медный купорос.
Губительно на микроорганизмы действует свободная углекислота, вводимая в воду в дозах 30-50 мг/дм при рекарбонизации ее с целью предотвращения карбонатных отложений.
Хлорирование охлаждающей воды. Охлаждающую воду периодически хлорируют, при этом интервалы между подачей хлора в воду и продолжительность каждого периода хлорирования зависят от степени загрязненности воды орга-
ническими веществами, микроорганизмами и интенсивности их развития. Режим хлорирования в каждом отдельном случае подбирается опытным путем.
Дозу хлора выбирают таким образом, чтобы в воде, прошедшей через наиболее удаленный от места ввода хлора теплообменный аппарат, концентрация активного хлора в воде в течение 30-40 мин была бы около 1 мг/дм3.
В качестве критерия для определения периодичности хлорирования можно принимать время, в течение которого на омываемых водой стенках труб образуется слой обрастаний толщиной около 0,5 мм. В связи с тем, что во многих случаях измерение слоя обрастаний в трубах и аппаратах затруднительно, часто применяют «ловчие», стеклянные пластинки (индикаторы), устанавливаемые в потоке воды.
Необходимый расход хлора, кг в сутки, может быть определен по формуле
где Q — расход охлаждающей воды, ч; — дозы хлора, г/м3; t — продолжи
тельность каждого периода введения, хлора, определяемая в процессе эксплуатации в минутах (ориентировочно можно принимать t = 40-5-60 мин с тем, чтобы концентрация остаточного хлора в выходящей из теплообменника воде была бы в течение 30 -40 мин около 1 мг/дм3); и — число периодов введения хлора в течение суток.
Вводить хлор в обрабатываемую воду следует с помощью хлораторов. Обработка воды медным купоросом направлена главным образом на борьбу с водорослями, развивающимися на градирнях (водораспределительные лотки, ороситель, стойки, каркас, обшивка и резервуар), а также в брызгальных бассейнах и прудах-охладителях оборотной воды. Для устранения развития водорослей в градирнях и брызгальных бассейнах применяют периодическую обработку воды медным купоросом 1-2 мг/дм в пересчете на Си (или 4-8 мг/ дм3 CuS04-5H20). Периодичность обработки зависит от интенсивности развития водорослей, она может колебаться от недели (летом) до месяца (в прохладное время года). Продолжительность подачи раствора медного купороса может быть в течение одного часа; при этом желательно подавать этот раствор в воду непосредственно перед градирней.
При обрастании градирен и оросительных холодильников колониями бактерий рекомендуется воду после обработки купоросом обрабатывать в течение 1 ч хлором дозой 7-10 мг/дм непосредственно перед охладителями.
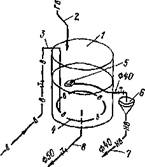
Устройство для растворения и дозирования медного купороса показано на рис. 3.15.
При использовании для целей водоснабжения вод из озер и водохранилищ нередко возникают существенные затруднения из-за обильного развития в них
Рис. 3.15. Устройство для растворения и дозирования медного купороса: / — бак растворный; 2 — подвод горячей воды; 3 — подвод воздуха; 4 — перфорированная воздушная труба; 5 — поплавковый дозатор; 6 —воронка; 7—трубопровод к камере нагретой воды; 8 — промканализация
|
§1 el |
|
|
в определенные периоды года планктона —так называемого «цветения» воды. Для борьбы с их развитием также применяют купоросование воды дозой от 0,1 до 0,5 мг/дм3 Си.
|
санитарной аіужбьі. |
Расход купороса для обработки воды в водоеме рассчитывается на создание необходимой концентрации в верхнем слое воды толщиной 1-2 м. Купоросование производится с лодок, а также самолетами