 Динамическая СУВ воды с параллельной раздачей. газов по элементам батареи
Динамическая СУВ воды с параллельной раздачей. газов по элементам батареи
Динамическая СУВ представляет собой замкнутый контур, в котором вынужденный поток водорода, проходя через ТЭ батареи и охлаждаемый конденсатор, обеспечивает удаление воды из зоны реакции.
Рассмотрим процесс тепло — и массообмена в ТЭ при испарении воды в вынужденном потоке водорода. Для исследования была принята упрощенная модель ТЭ (рис. 5.3). Она представляет собой два
![]()
![]() н*
н*
і і і m і і г і і гтттгтті і 11 і і 11
I I ( пт II I I I I п I г I I I I Г I IT IT
X/l
Рис. 5.3. Упрощенная модель ТЭ.
І
t
тонких пористых электрода с распределенными источниками теплоты. Толщина электродов мала по сравнению с их линейными размерами и не превышает 1 мм. Электроды разделены водным раствором гидроокиси калия. В процессе работы ТЭ в нем образуется вода и выделяется теплота. Вода образуется со стороны водородного электрода. Принимается, что образующаяся вода поступает в электролит и перемешивается с ним, т. е. испарение воды происходит из электролита. Количество образующейся воды согласно закону Фарадея пропорционально току нагрузки. Количество выделяющейся теплоты определяется теплотой диссоциации при электрохимической реакции, омическим сопротивлением и поляризационными потерями и равно
Р=1 (Еф—U),
где / — ток нагрузки; Еф — фиктивное значение ЭДС, рассчитанное по тепловому эффекту реакции; U — напряжение ТЭ.
Принимается, что выделяющаяся теплота распределяется между электродами равномерно. Поток водорода, проходя над поверхностью электрода, частично потребляется на реакцию, подогревается и насыщается парами воды за счет ее испарения. Со стороны кислородного электрода расположен теплообменник для съема теплоты. Очевидно, что поле температур и концентраций электролита в реальном ТЭ должно быть описано весьма сложной системой дифференциальных уравнений, решение и анализ которых представляет значительные трудности.
Введем некоторые допущения, позволяющие провести количественные оценки и выявить основные зависимости, пе искажая существа протекающих процессов.
Основные допущения и уравнения тепломассообмена
1. Рассматриваем стационарный во времени процесс.
2. Процесс токообразования протекает равномерно по всей поверхности электрода и не зависит от температуры и концентрации электролита.
3. Коэффициенты тепло — и массообмена принимаем постоянными по длине электрода.
4. Концентрация электролита в поровом пространстве постоянна.
5. Теплопроводности в газе м электролите не учитываются, так как они малы по сравнению с теплопроводностью электродов.
6. Утечками теплоты с поверхности ТЭ пренебрегаем.
7. Рассматриваем одномерную в направлении потока водорода задачу, поскольку основной градиент температур и концентраций имеется в направлении потока.
8. Скорость диффузии пара с поверхности электрода в потоке водорода определяется формулой Дальтона [5.8], которая справедлива для стационарного процесса влагопереноса при испарении жидкости со свободной поверхности.
9. Не учитывается зависимость физических свойств электродов, электролита и хладоагента от температуры.
С учетом сделанных допущений система уравнений тепломассообмена для рассматриваемого случая примет следующий вид.
Уравнение теплового баланса для потока водорода
clyr (Qm, срТі = <*т®(^2 Т) + и — ,Х .
|
3,36 . |
||
|
і)С/>Н,07’2 — |
9 1ср н/. — |
(5.1) |
|
( ^н, о, 1 |
||
|
‘Г V СН20,2 |
1 — массовый |
расход |
пароводородной смеси; Q“ — массовый расход сухого водорода на сходе в элемент; g*H^—удельный расход водорода, потребляемый на реакцию; CHj0= Ры2о’^нго^ — концентрация воды в потоке паро.
водородной смеси; ат — коэффициент теплоотдачи от электрода к потоку водорода; Тг — температура потока водорода; ам — коэффициент массо(влаго) обмена.
Уравнение теплового баланса для водородного электрода ;
ёгТ, а„ і
~ёхГ=~1ц (^0, 2“ сн2о, і) (<>Н,0 т2 + г) +
где Тг — температура водородного электрода; qH(?r — тепловыделение на водородном электроде; q^c2T — f = (£ф — U) 7-Ю4; {/ — напряжение элемента; Еф — фиктивное значение ЭДС ТЭ, рассчитанное из теплового эффекта реакции; / — плотность тока, снимаемого с ТЭ; г — теплота испарения.
Граничные условия:
![]() _dj І
_dj І
*=о_Лс L=i’
^Н,0 ,1 ^=o = Cff, o. 1 •
Уравнение баланса масс для электролита
![]() где Сн 0 2=у(1—Скон/100)—концентрация воды в электролите; Скон — массовая концентрация электролита; у — плотность электролита; DHs0—коэффициент диффузии воды в электролите.
где Сн 0 2=у(1—Скон/100)—концентрация воды в электролите; Скон — массовая концентрация электролита; у — плотность электролита; DHs0—коэффициент диффузии воды в электролите.
Поскольку достоверных значений коэффициента диффузии еоды в электролите в литературе найти не удалось, принимаем, что DHao = DK0H (этим допущением несколько занижается поток воды, поскольку известно, что £>н2о > -°КОн)• Коэффициент диффузии щелочи в электролите зависит от температуры и концентрации [1.1]:
где А, В — эмпирические коэффициенты; См—молярная концентрация; Д0 — коэффициент диффузии при бесконечном разбавлении. Используя приведенное соотношение и экспериментальные ре-
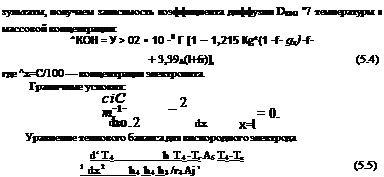 |
|
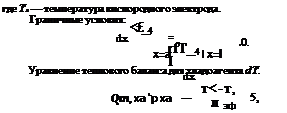 |
|
|
|
|
|
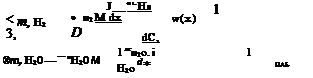 |
|
|
|
|
|
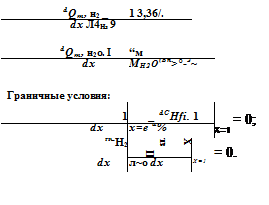 |
|
|
|
|
|
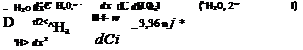 |
|
Так как скорость потока w(x) — меняется ‘незначительно, то вместо (5.7) я (5.8) можно записать
Таким образом, получена замкнутая система дифференциальных уравненяй, описывающих процесс тепломассообмена в ТЭ. Аналитическое решение полученной системы представляет известные трудности. Решение полученной системы удобнее производить численным методом с применением ЭВМ. Однако для некоторых частных задач, представляющих практический интерес, можно получить решения системы уравнений в явном виде.