Открытая система. Хемостат
Открытая система. Хемостат
Океан, как и клетка, является открытой системой, открытой для обмена веществом и энергией с окружающей средой (для внешнего метаболизма), и следовательно, он должен обладать определенными свойствами, характерными для любых открытых систем, делающими их похожими друг на друга. Чтобы отчетливо представить себе особенность этих свойств,’ сравним динамику процесса в открытой и закрытой (для обмена веществ) системах. Для примера возьмем двуокись углерода, растворенную в морской воде. Пример закрытой системы — фотосинтез в закрытой склянке, в которой из живых организмов находятся только фотосинтезирующие водоросли. Если концентрация водорослей постоянна, то скорость фотосинтеза, регистрируемая по убыли двуокиси углерода, прямо пропорциональна наличной концентрации С02, (сі):
|
|
(92)
Начальное условие с = с (0) при t — 0.
Значение интеграла можно найти в таблице интегралов. Получим.
|
(93) |
с, ~сг(0)e-*ia<.
По виду уравнения (93) можно легко предсказать, что же произойдет с. СОг в закрытой системе. С увеличением времени t экспонента, а значит и с і постепенно становятся все меньше. При достаточно большом времени опыта, в крайнем’ случае при t, стремящемся к бесконечности (f->оо), экспонента равна нулю, и следовательно, Сі = 0, . —
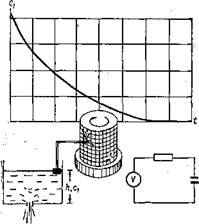
’ Можно не прибегать к интегрированию, чтобы получить точную зависимость с от t, а воспользоваться. какой-нибудь хорошо известной из практического опыта аналогией. Такой метод, называемый методом аналогового моделирования, широко и эффективно используется при изучении различных динамических систем. Например, опыт с «дырявой кастрюлей» (рис. 31) . Уровень воды h в такой кастрюле, аналогичный по математическому смыслу концентрации а, понижается со временем, по уравнению (92), тем быстрее, чем выше
|
Рис. 31. Гидродинамическая и t электрическая модели. реакции (92) в закрытой системе. . |
уровень воды и чем больше величина отверстия, которая аналогична константе скорости kn. Такой метод, называемый гидродинамическим моделированием, успешно использовался до недавнего времени для самых серьезных и важных расчетов. Или же хорошо известное даже из школьного курса обстоятельство, что напряжение U в электрической ^С-цепи падает точно в соответствии с уравнением (92):
dU 1
|
■и, |
|
dt |
(920
напряжение U аналогично концентрации с, а величина 1/# аналогична константе скорости кц.
Этот метод благодаря быстроте электрических процессов и возможности простой, точной, надежной и наглядной регистрации результатов на самописцах или ца цифропечатающих устройствах широко используется в настоящее время. Самописец, соединенный с потенциометром или с поплавком в «дырявой кастрюле», проинтегрировав уравнение (92), начертит точно по уравнению (93) график зависимости концентрации СОг. от времени опыта в виде кривой, изображенной на рис. 31 (напомним, для закрытой системы). .
|
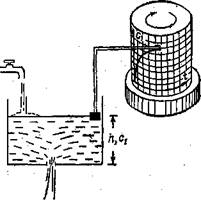
Рис. 32. Гидродинамическая модель реакции (94) в открытой системе. |
Теперь легко можно промоделировать этот процесс для условий открытой системы. Подсоединим к «дырявой кастрюле» кран и приоткроем его (рис. 32). Очег видно, если мы достаточно’ открыли кран и дыра в кастрюле не слишком велика, несмотря на то, что часть воды из кастрюли выливается, в ней начнет прибывать вода. Но по мере того, как уровень воды будет повышаться, скорость оттока воды через дырку, пропорциональная уровню воды, тоже будет возрастать. Наконец* наступит момент, когда скорость притока воды из крана и скорость оттока воды через дырку станут совершенно одинаковыми и уровень воды закрепится на одном, определенном месте, а именно на месте, определяемом скоростью потока из крана и величиной дыры в кастрюле;. Здесь существенны два обстоятельства. Первое: этот постоянный, стационарный, уровень может сохраняться неизменным как угодно долго, пока не изменится поток из крана. Второе: получим совершенно тот же. по величине стационарный уровень, если в любой момент времени— в самом начале, как только открыли кран, в середине или в конце, когда установился стационарный уровень, — плеснем в кастрюлю дополнительную порцию воды, причем как угодно большую, пусть даже кастрюля наполнится до краев. Если при этом уровень воды превысит тот самый предопределенный притоком из крана и дырой (т. е. кинетическими параметрами) стационар— ный уровень, то при такой высоте уровня воды в кастрюле напор будет велик, и скорость истечения воды через дыру превысит скорость притока воды из крана—• уровень начнет понижаться и до тех пор, пока не займет свое предопределенное положение. Такое свойство открытых систем — предопределенность стационарного состояния кинетическими параметрами и независимость его от состояния системы в достационарное время — называется эквифинальностью. Аналогично этому будет и поведение нашей открытой химической системы, динамику которой мы уже промоделировали, имея в виду, что изменение уровня воды в кастрюле аналогично изменению концентрации вещества в морской воде, приток из кр. а-’ на — поступлению вещества в океан, а отток через дырку— исчезновению вещества из морской воды.
Оставим, однако, аналоговые модели для более сложных задач, тех, аналитическое — решение которых (т. е. точное математическое решение в виде формул) получить очень трудно либо вообще невозможно. Пока сложность задачи позволяет получить формулу, даже приближенную, ее стоит получить, потому что аналитическое решение обладает определенным достоинством, .которого не знает даже мощнейшая ЭВМ, а именно — общностью, тем, что исследователь не связан с конкретными цифрами и параметрами. Начнем анализ открытой системы опять с растворенной СОг, потом попытаемся обобщить результат. Предельно упростим задачу, пренебрежем для этого обратным потоком k2 и остальной частью карбонатной системы. В левой части уравнения запишем то, что наС интересует: скорость изменения концентрации С О 2,01: :dci/dt. В правой части сведем. баларс: мы должны при наших упрощениях учесть обмен С02 с атмосферой и по-
требление СОг на фотосинтез. Таким образом, учитываем в приходной части: 1) скорость образования СОг в системе равна нулю ri, (+) = 0; 2) скорость поступления С02 из атмосферы ®ь (+) пропорциональна ее растворимости Yi при данных условиях и ее концентрации с’ в атмосфере w, (+) = аіуіс/; в расходной части: 1) скорость расходования СОг на фотосинтез, как-уже делали, примем равной гь (_) = йігСь 2) выделение С02 в атмосферу СО СКОРОСТЬЮ W, (_) = 61С1. •
Теперь запишем балансовое уравнение, приведя его к виду, удобному для обобщения:
■ dCd =П, (+> + «’1, (+) — П, (-> — п>1, (-) =
= Otjf jCj ^1^1 ==: alT 1^1 (^12 ^l) (94)
Если бы мы хотели учесть еще какие-либо статьи баланса, мы аналогично добавили бы в правую часть соответствующие слагаемые. Уравнение (94) можно, решить очень легкй, если считать величину с постоянной.
Интегрируя уравнение (94) при начальном условии Сі = Сі(0) — при t = 0, получим:
„ “iVi {„ кл “iTici
с^-^г)^+К) С95)
В отличие от закрытой системы, как это и предсказано гидродинамической моделью, здесь при достаточно большом времени t-*~°о, когда экспоненциальный член становится равным нулю, значение сі перестает понижаться и действительно достигает предела (обозначим его Сі):
— а,-‘ с, .
Сх~ ^12 + 5! ’ . ■ (96)
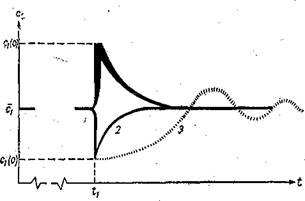
Т. е. СО временем В открытой системе концентрация Cl достигает стационарного значения а, причем это значениеСі не зависит от самой наличной концентрации С02 в морской воде, а определяется концентрацией ее в атмосфере (с,) и кинетическими параметрами (эквифиналь — ность). Предположим, что внезапно произошло возмущение в момент временн ой разовое увеличение концентрации С02, например, из-за вулканического выброса в океане (кривая 1 на рис. 33) или’уменьшение сь например, из-за резкой интенсификации фотосинтеза (кривая 2 на рис. 33). Тогда, согласно уравнению (95), концентрация СОг (сі) постепенно автоматически выравняется до прежнего стационарного уровня с і сверху (кривая 1) или снизу (кривая 2) соответственно, независимо от того, до таких значений произошло первоначальное изменение концентрации ССЬ; ее стационарное значение соответственно принципу эквифинальности предопределено кинетическими параметрами.-
|
Рис. 33. Переходный процесс в открытой динамической системе первого — кривые (/), (2) и более высокого — кривая (3) порядка после возмущения в момент вре-. мени t, в результате которого произошло повыше — ниє (1) или понижение (2) концентрации Сі от стационарной cj до Сі (0). |
Легко заметить, что временные переходные характеристики, представляемые этими кривыми на рис. 33, аналогичны пространственным переходным характеристикам на рис. 30. Суть аналогии ясна — и в том и в другом случае речь идет о переходе соответственно. во времени и; в пространстве от возмущенного состояния к стационарному, эквифинальному. Оба рисунка совместно дают представление — о пространственно-динамической структуре океана, о саморегулировании в нем и о причинах его устойчивости.
Из уравнения (94) стационарное значение с легко получить без всякого интегриррвания, просто из условия
стационарности. Перепишем, учитывая условие стационарности (dci/dt = 0), уравнение (94), отметив черточкой стационарные с. Получим алгебраическое уравнение — . ‘
aihc’i — (£12 + 8i) £1 = 0, (94′)
|
W ^12 + |
|
(960 |
решим его
Выражения (960 и (96) полностью совпадают.
Используя этот простой способ, покажем, что вся система в целом, со всеми ее химическими компонентами, аквифинальна и что океан, следовательно, подобно живой клетке, стремится в ответ на возмущение вернуться в определенное природными условиями стационарное состояние. Не будем при этом ограничиваться какими-то определенными химическими компонентами и определенными видами обмена веществ.— это может быть и речной сток, и обмен с атмосферой, и обмен с дном.
Для п компонентов этой системы, в том числе для изображенных на рис. 29, аналогично выше описанному может быть выписано п линейно независимых дифференциальных уравнений, совокупность которых полностью описывает динамику системы: ~
~^Г~ = П, (+) — п, (_) + Wi’ (+) — wt, <-) = •
— = а(Т/с« ~Ь w‘, <+) — {ki, і++ A) ci
.. (г= 1, 2, ..я), (97)
где Гр (+), гц-)— скорости соответственно образования и расходования г’-того компонента; Сі, с/ — концентрации компонентов соответственно в системе и вне ее, откуда этот компонент поступает в систему; аг-, уи Si— коэффициенты, вид которых зависит от того, каким образом реализуется обмен веществ с окружающей средой.(некоторые из них могут быть равными нулю или единице). — • — …
Из общей совокупности, уравнений (97) можно определить все стационарные концентрации с,-, пренебрегая
для этого производными dci/dt, как в (94′), и решая полученную таким образом систему алгебраических уравнений:
Г1> ( + ) (С1> СЪ ■ • •> Сп) ~ г1, (—) (с1> ^2) • • •> сл) ~Ь ( + ) (^li ^2і • • •> £„• ^2, . • •, Сл)
— «»,,(_) (с J, С2, С„, сі, 4 .Сл)=0
. ‘ (/=1, 2………. я). (98)
Так как уравнение (98) не содержит начальных и текущих концентраций Сг(0), а, то определяемые из уравнения (98) стационарные концентраций а никак не зависят от начальных с,(0) и вообще от концентраций компонентов в любой момент времени. Таким образом, для всей системы в целом выполняется принцип эквифиналь — ности.
Но трудно предполагать, чтобы приток веществ в океан всегда был постоянным. Другими словами, в нашей гидродинамической модели (см. рис. 32) кран, скорее всего, пульсирует. Если интервалы между пульсациями гораздо больше, чем время «ответа» системы — время ее возвращения в прежнее состояние, то такие возмущения никак не скажутся на состоянии системы, даже если приток из крана соизмерим с количеством воды в кастрюле. В случае же океана приток ничтожен по сравнению с его массой, и даже частые «пульсации» не скажутся на его химическом облике.
Читатель мог бы промоделировать реакцию системы, скажем, на экспоненциально растущее возмущение — загрязнение океана.
Если из рис. 29 для упрощения изолировать элементы с/, Сі, Сі от остальной части системы и рассматривать как прямой (km), так и обратный (&2i) потоки, то при термодинамически устойчивом равновесии должно быть
с2 ^12 TS
Cl ~ *21 ~А’
где К — константа равновесия. Аналогично предыдущему, из уравнений (97) легко-показать, что соотношение стационарных концентраций СОг, ок и растворенного
где. . . .
|
органического вещества (РОВ) определяется выражением |
|
|
т. е. отношение стационарных концентраций сг/сі-не равно константе’ равновесия К = &12/&21, как это должно быть при условии термодинамического равновесия. Эти выводы можно распространить и на всю систему целиком, т. е., несмотря на протекающие процессы трансформаций соединений углерода, в системе как угодно долго могут поддерживаться термодинамически неравновесные концентрации веществ. Океан, таким образом, как и клетка, как и любой живой организм, является «хемостатом», термодинамически неравновесной системой, сохраняющейся в стационарном состоянии благодаря обмену веществ с окружающей средой; это термодйнами — чёски неравновесное стационарное состояние и есть его «жизнь». Напрашивается вопрос: нельзя ли рассчитать, как долго будет сохраняться это состояние стационарности. Клетке удается сохранять его сутками и годами, организму — десятками и сотнями лет. А океану? Можно ли рассчитать предопределенное параметрами системы (как и в случае клетки, организма) время жизни океана? Пока не известно.
Обычно химики, когда нет ни теоретической, ни экспериментальной опоры, апеллируют к массам элементов системы. Последуем этому пути: масса клетки 1 • 10-18— — 1-Ю-20 кг, время жизни сутки X fi] масса организма /г-10-1 — /г-102 кг, время жизни п — /г-102 лет; масса океана 2 • 1021 кг, «время жизни» больше 1010 лет. «Прожито» 3 — 5 • 109 лет. Так что океан еще пока молодой организм в расцвете сил?
Конечно, приведенные выражения и рисунки до чрезвычайности упрощают картину, хотя и передают основной смысл и тенденцию. Стационарные концентрации, конечно же, не достигаются плавным монотонным изменением, аналогичным кривым 1 и 2 на рис. 33 (здесь,, преднамеренно упрощая картину, представляем рассмат-
риваемую систему как динамическую систему первого порядка). В действительности же ее порядок заведомо выше первого. Кривая 3 на рис. 33 отражает реакцию более сложной системы на то же самое возмущение. Как мы видим, в этом случае переходный процесс от возмущенного состояния к стационарному может носить иной характер, например может оказаться колебательным. Однако для нас сейчас существенно лишь то, что в этом случае, при затухающих колебаниях, принцип эквифи — нальности не нарушается, а при колебаниях незатухающих действует принцип сохранения средних значений — система устойчива.
Наивно было бы полагать, что замечательная устойчивость «параметров» океана обеспечивается только этими принципами. В действительности, кроме этих мощных, но грубых механизмов регулирования, на каждом уровне системы функционируют специальные механизмы тонкой регулировки, причем обычно обеспечивается многократная и разнообразная подстраховка — залог надежности работы всей системы. Эту автоматику с подстраховкой можно увидеть, проследив за ионами Н+.