Почему все течет и изменяется, но выглядит неизменным. Карбонатная система
Почему все течет и изменяется, но выглядит неизменным. Карбонатная система
Для того чтобы ответить на поставленные выше вопросы о причинах устойчивости химического облика океана, границах этой устойчивости и обеспечивающих ее механизмах, обратимся к основному представителю ■соединений углерода, вписанному в периодическую таблицу морской воды, к НСОзС, и проследим, как он связан по крайней мере с самыми ближайшими ему «родственниками». При этом снова обратим внимание на то, что мы следим лишь за одной углеродной «семьей»,
предполагая увидеть в ее судьбе наиболее важные динамические особенности жизни всего химического «госу: дарства» океана. ,
Для упрощения ограничимся пока одним звеном превращения, например диссоциацией НСО~з:
■ нсо3-^н+ + сс>2- (86)
Одновременно протекают две реакции. Одна (условно скажем — прямая)
‘ HC03—vH+ + C02- (87)
со скоростью r_ = — d [НСОз-]/^. Концентрацию (моль/л), как принято в химической кинетике, будем обозначать квадратными скобками. По основному закону химической кинетики — закону действующих масс — скорость реакции^пропорциональна концентрации реагирующих веществ или, в случае растворов, —их активностям (величинам, пропорциональным концентрациям). .Для упрощения дальше везде не будем записывать поправку на активность. Можно считать, что она входит в. константу скорости (k_): .
г_ = *_[НСОг]. (88)
Коэффициент пропорциональности k_ в уравнении’ (88)—константа скорости, или удельная скорость: скорость реакции при [НСО3—] = 1.
Для другой (условно скажем — обратной) реакции
Н+ + С01—*НС03- (89)
уравнение скорости г+ — d [НСОз~]А# запишется в таком виде: ,
r+ = k+[H+] [С02-]. (9Q)
Допустим, в колбу с чистой водой добавили какое-то количество НСО-3. Начнется пёрвая реакция (прямая) со скоростью, определяемой уравнением (88), причем по мере уменьшения концентрации НС03- скорость прямой реакции будет падать. При появлении первых же ионов Н+ и СО|- начнется вторая (обратная) реакция. Вначале, согласно уравнению (90), ее скорость будет мала, но по’мере нарастания [Н+] и [С032-] скорость
обратной реакции будет возрастать все больше и боль
ше, пока скорости прямой и обратной реакций не
сравняются. Хотя реакции продолжают непрерывно идти, концентрации всех ионов остаются неизменными и их соотношения определяются условиями наступившего динамического равновесия ‘
Г+ = Г_, К [Н+] [СВД = Л_-[НСО,-],
или
|
к, (91) |
К] [СОГ] k_
|
+ |
[HCOf] k
где К — константа равновесия. Если и k+ учитывают коэффициенты активности, то К — термодинамическая константа равновесия (в данном случае — равновесия диссоциации). Значение ее связано’с определенными термодинамическими потенциалами. Чем полнее может протекать реакция в прямом направлении, тем больше константа равновесия. В данном случае она порядка /С~10-11 (для сравнения часто используют не К, а только показатель степени без знака минус, обозначая его рК, если речь идет о константе равновесия), т. е. рК =11. Значение К очень мало, и реакция протекает неполно, поэтому в морской воде больше 80% неорганического углерода существует в виде НС03_.
Мы собирались наблюдать лишь за одной углеродной — «семьей», но с первых же шагов, желая количественно описать поведение хотя бы одного «члена семьи», вынуждены следить не только за углеродными соединениями, но и за Н+. Последний, если перейти от «маленькой» системы к океану, связан такими же обратимыми реакциями с массой других веществ внутри своей «семьи» и с соединениями других элементов: кремния, бора, фосфора, серы, — все трудно перечислить в паутине связей. Этот пример иллюстрирует исключительно важный при рассмотрении природных систем принцип тотальной взаимосвязанности концентраций всех веществ в равновесной системе: в условиях равновесия концентрации всех веществ, участвующих в реакции, связаньї между собой. Нельзя изменить концентрацию ни одного из них, чтобы это не вызвало такого изменения концентраций всех остальных веществ, которое приводит к прежнему численному значению константы равновесия при данных условиях.
Таким образом, устойчивым состоянием — такой системы будет только равновесное состояние, когда выполняется соотношение (91).
Выведем рассматриваемую «маленькую» систему из состояния равновесия и проследим, как она откликнется на это. Пусть «возмущением» будет добавка Н+. За ответом системы можно проследить по схематическому (86) или математическому (91) изображению связей в этой системе. Из схемы (86) видно, что если увеличить [Н+], то повысится скорость обратной реакции (89). Дополнительные количества Н+ и С032_ свяжутся в НСОз — и через определенное время, которое можно рассчитать из уравнений (88) и (90), вновь наступит устойчивое равновесие. Причем концентрация [НС03-] повысится, а концентрации [СОз2-] и [Н+] понизятся по сравнению с возмущенным состоянием. Таким образом, ответом системы на возмущение будет сдвиг равновесия влево, стремление понизить «избыточную» концентрацию [Н+]. Такой отклик системы известен как принцип демпфирования (Ле-Шателье—Брауна): если на систему, находящуюся в устойчивом равновесии, оказывать внешнее воздействие, то в системе усилится то из направлений процесса, течение которого ослабляет влияние этого воздействия, и положение равновесия сместится в том же направлении. .
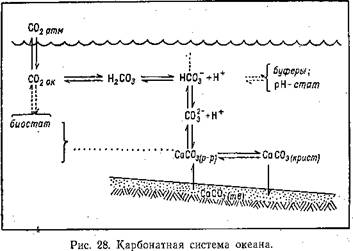
На рис. 28 схематически изображена вся карбонатная система океана, от С02 атмосферы, растворяющегося в морской воде и образующего угольную кислоту, которая диссоциирует до бикарбонат-ионов НС03“ а последние >— до карбонат-ионов СОз2~, которые связываются ионами Са2+ в СаСОз — плохо растворимое соединение, вплоть до звена равновесия с донными отложениями океана. Вместо изображения связей компонен тов карбонатной системы с другими элементами и системами на рисунке поставлены многоточия, иначе не хватило бы рисунка, так обширны и многообразны связи системы. Обязательно пришлось бы показать, а показав, и подробно рассмотреть, связи СОг, например, с биологическими системами океана. СОг поглощается фитопланктоном при фотосинтезе и выделяется при дыхании микроорганизмов. Уменьшение [С02] из-за фотосинтеза вызывает увеличение pH. и влияет на равновесие всей карбонатной системы,
/
Используя принцип демпфирования, можно оценить, как скажется на равновесии в этой системе изменение концентрации какого-либо компонента или внешних условий, а с помощью константы равновесия — и рассчитать довольно точно отклик системы на возмущение. Отошлем интересующихся такими оценками и расчетами к учебнику шх химии океана1, где можно, кроме того, почерпнуть сведения и о смещениях карбонатного равновесия в различных районах и на разных глубинах океана под действием различных причин, о смещениях,
|
|
сопровождающихся выпадением и растворением «морского снега» — СаСОз, и о пересыщении воды углекислым газом и карбонатом кальция. Обратим внимание только на последнее. В верхних слоях океана регулярно наблюдаются устойчивые во времени пересыщения вод карбонатом кальция, достигающие 300% и выше, а в глубоководных участках океана часто наблюдаются, наоборот, устойчивые недонасыщения вод карбонатом кальция по сравнению с теми величинами, которые диктуются константой равновесия, следовательно, веесиль-
1 Алекин О. А. Химия океана. Л., Гидрометеоиздат, 1966, 247 с. . ‘ ‘ . .. —
Ш .
ными законами термодинамики. Между тем в разобран^ ных нами примерах показано, что устойчивым состоят нием является равновесное состояние. Откуда противоречие?
Обратимся к термодинамике равновесия. Константа равновесия связана с Изменением свободной энергии AF соотношением.
Л?7’In К— — AF
и с изменениями энтропии и внутренней энергии А Я соотношением
RnK = bS
При Af<0 /(>1, скорость прямой реакции г- больше, чем скорость обратной реакции г+: г-> г+. При AF>0 К<1, /•_</+. Условие равновесия: F минимально, dF = 0, > 0; 5 максимальна,
‘ dS = 0, d2S ^ 0. Учитывая приведенное в самом начале книги соотношение (стр. 21) энтропии и термодинамической вероятности, придем к хорошо известному из статистической механики выводу: равновесное состояние, к которому, по второму закону термодинамики, стремится всякая термодинамическая система, наиболее вероятно по сравнению с любым другим, смежным с ним состоянием, при данных условиях.
Другие состояния менее вероятны, менее устойчивы, и переход к ним из состояния устойчивого равновесия всегда связан с необходимостью затраты работы. Так, если подбросить пирамиду, то наиболее вероятно, что она, упав, будет стоять на одном из оснований,, а не на вершине, «вниз головой», и перевод ее в менее устойчивое состояние — основанием вверх — потребует работы. Дым от сигареты стремится рассеяться, т. е. система аэрозоли — воздух стремится снять наведенную курильщиком упорядоченность, неравномерность в ней, стремясь к максимуму меры неупорядоченности — энтропии. Как было подмечено богословом Ламишниным, без аппелирования к энтропии: «Во вселенной превалирует разрушение над созиданием, и вещество стремится — к рассеянию»[28].
Однако в океане вопреки всему мы обнаруживаем явные нарушения этих — законов: наличие упорядоченности вопреки энтропийным тенденциям. .
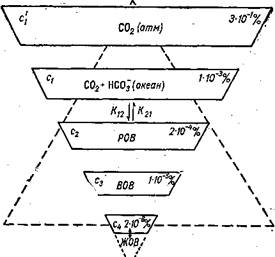
Вслед за биологами, хронологически сделавшими это раньше (см. гл. III), построим химическую пирамиду масс; выпишем концентрации основных форм, в каких встречается углерод в океане и над ним. Так как придется сопоставлять газовую фазу с жидкой, выразим
|
/ V Рис. 29. Пирамида масс (по К. М. Хайлову) и пирамида упорядоченности (пунктир). |
РОВ — растворенное органическое вещество, ВОВ — взвешенное органическое вещество, ЖОВ — живое орга* ническое вещество. .
концентрации в процентах и обозначим их значками d (рис. 29). Пирамида, выстроенная по концентрациям форм углерода — сплошные линии — обратна пирамиде, выстроенной по признаку усложнения, упорядочения этих форм (пунктир) от СОг атмосферы до взвешенного органического вещества и далее (см. гл. III). Соотношения мало изменяются во времени, они устойчивы. Постоянный уровень этих термодинамически неустойчивых
сложных образований океан поддерживает за счет работы своих биологических систем, использующих световую энергию. Чем выше уровень упорядоченности форм соединений углерода, тем большая работа на — их образование затрачивается и поэтому тем меньше их концентрация. Такую работу совершает, например, живая клетка — термодинамически неравновесная система, она м. ожет поддерживать устойчиво свое существование только непрерывным обменом веществ с окружающей средой — метаболизмом. Отсутствие метаболизма означает смерть, и бывшая некогда живой, система, ставшая «закрытой», деградирует, спускаясь по ступеням пирамиды масс к уровням все меньшей упорядоченности, все большей энтропии и термодинамической устойчивости — ОТ уровня Сі до уровня Си.
Океан, как и клетка, ведет интенсивный обмен веществами— с дном, материками, атмосферой. Как клетка перераспределяет химические вещества между компонентами тела, так и океан в состоянии перераспределять соединения угл’ерода между своими химическими и биологическими системами и транспортировать их во внутренние, сравнительно инертные, пределы океанической массы от областей активного внешнего обмена веществом и энергией. Активные слои океана, естественно, прилегают к его поверхностям раздела с атмосферой, берегами, дном, через которые ведется обмен и вблизи которых поэтому наблюдается максимальное разнообразие условий и максимальная концентрация высокоорганизованных форм вещества. Благодаря подвижности океанической массы эти активные слои распространяются от поверхностей раздела на значительные расстояния как по горизонтали, так и по вертикали. Но размеры океана намного превышают протяженность активных слоев, и основная часть океана, глубинная и удаленная от берегов, была бы совсем инертной,- если бы не внутренние поверхности раздела, которые, как и в живой клетке, играют внешне незаметную, но незаменимую роль. Это — поверхности фронтов течений и «инородных» вод, границы с твердыми объектами, большими, как острова, или микроскопическими, как — взвешенные в морской воде частицы, детрит. Влияние остро-. вов заметно и невооруженному — глазу — это вспышка растительной и животной жизни среди гораздо менее
активных океанических просторов. Существует даже термин— «островной эффект». Термина «детритный эффект» не существует. Эти поверхности раздела скрыты от глаза. И как всегда люди забывают о глобальных последствиях особенностей микромира. Между тем эти поверхности раздела имеют совершенно уникальные особенности. Они повсеместны в океане. Их общая площадь при микроскопических размерах самих частиц превышает суммарную площадь всех остальных поверхностей раздела вместе взятых, включая признаваемую наиболее «важной» поверхность океан — атмосфера. Естественно — внутренние поверхности раздела в клетке превышают площадь ее наружного покрова, иначе вряд ли она могла бы жить. Легко подсчитать, что если 1 см3 твердого тела с площадью поверхности соответственно кубу 6 см2 измельчить до кубиков размером с глинистые частицы (ребро 0,001 мм), то общая поверхность образовавшихся частиц станет равной 60 000 см2. Благодаря тому что силы молекулярного притяжения на поверхности не полностью уравновешены взаимодействием соседних молекул, любые поверхности раздела активны. Великий термодинамик Гиббс говорил о сгущении свойств и термодинамических характеристик на поверхностях раздела фаз. Особенно активны свежеобразованные поверхности, так как на них могут образовываться свободные радикалы— сверхактивные химические частицы. .
В лабораториях они иногда вызывают, подобно электрической искре, взрыв горючих смесей, хранящихся в колбе, если в ней образовалась свежая трещина. Поверхностный слой (фактически пленка) кристаллических тел и металлов (слой Бэйлби) аморфизирован и вещество в этих слоях проявляет чрезвычайную химическую активность. Например, растворимость аморфизирован — ного слоя кварца в 20 раз выше чем нижерасположенных кристаллических слоев. В химических лабораториях активные поверхности находят разнообразное применение. ■ .
Некоторые процессы полимеризации, обычно проводимые в «жестких» специальных условиях, удается вести в лабораториях при нормальной, комнатной температуре, если использовать активную поверхность даже обычной тонкоразмолотой соли. Трудно предположить,
чтобы в химической лаборатории океана природа пренебрегала такими возможностями. Не в этом ли кроется недостающее энергетическое звено для объяснения самопроизвольного образования в древнем океане биологических полимеров? Пока ученым для объяснения этого приходится прибегать к чрезвычайным обстоятельствам, таким, как электрические атмосферные разряды, хотя их роль, как отмечено выше, вполне может сыграть простая трещина на поверхности частицы. И не явится ли разгадка тайн химии моря одновременно разгадкой тайны происхождения жизни? Не могло бы отправной точкой для построения модели биосферы послужить представление о Земле, как о космической кристаллической частице с аморфизированным активным слоем — биосферой? Тогда модель океана была бы сложным блоком в общей модели биосферы. По-видимому, есть также глубокая аналогия между поверхностными аморфизиро — ванными слоями и активным поверхностным слоем океана. .
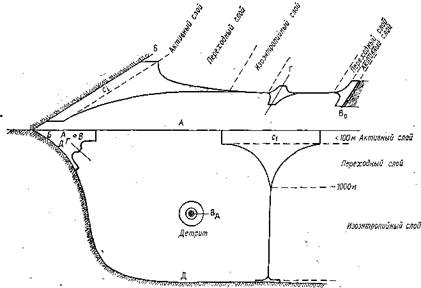
Можно попытаться построить простейшую схематическую модель пространственной, горизонтальной и вертикальной структуры океана с однородным, аморфизированным активным слоем на его поверхностях раздела.
— При простейшем («ламинарном») режиме транспорта вещества и энергии между однородным активным и однородным максимально удаленным от поверхностей раздела слоями уравнением динамики для переходного между ними слоя будет уравнение первого порядка, при одномерной модели (одна пространственная координата): •
Здесь Сг — набор отдельных свойств различной природы, W — составляющая скорости транспорта, I — расстояние от границы активного слоя по горизонтали или по вертикали, f(C{)—положительный или отрицательный источник.
Функции источника f(cj) могут быть самыми разнообразными. При простейших видах /_(сг-) и при условии стационарности (da/dt = 0) общим решением уравнения будет одноэкспоненциальная функция, т. е. переходный режим с монотонным затуханием — понижением или
повышением Сі до стационарного значения по мере удаления от границы активного слоя, в зависимости от граничного условия. Соответствующие этому кривые приведены нарис. 30. Действительно, многочисленные и разнообразные свойства обнаруживают именно такой общий характер горизонтального и вертикального распределения: понижающиеся кривые характерны для тех компонентов и свойств, которые повышены в активном
|
Рис. 30. Пространственное изменение активности процессов и концентраций компонентов Сі с удалением от поверхности — раздела: А—с атмосферой; Б — с берегом;. Д — с дном. В0 — внутренняя граница островная; Вд внутренняя поверхность раздела детрит— вода; Г — гидрологическая граница. В прибрежье— комбинация максимального числа различных поверхностей раздела. |
слое за счет работы организмов — это сложные структуры и связанные с ними процессы (биомассы, продукция, концентрации органического вещества, скорость биохимического потребления кислорода) или за счет обмена со средой (температура, концентрация солей); повышающиеся кривые — для тех, которые понижены в
активном слое за счет работы организмов (биогенные элементы) или обмена со средой (также температура, концентрация солей). Еще более точная картина получится, если учесть турбулентный перенос в открытой системе. ,
Таким образом, учет того, что система открыта для обмена веществом и энергией, позволяет набросать общую упрощенную картину упорядоченной пространственной структуры океана.