Система автоматического регулирования pH
Система автоматического регулирования pH
Концентрация водородных ионов в океане чрезвычайно низка: 2-Ю-8 — 4,5-Ю-9 г/л, ниже почти всех других элементов, присутствующих в морской воде, в том числе серебра, урана и даже редких элементов — лантана, иттрия, церия. Несмотря на это, она является важнейшим условием нормального развития биологических и биохимических процессов, [Н+] определяет их оптимум, а также форму _ существования борной, кремневой, фосфорной и других кислот, стабильность ионов большинства металлов в воде, коррозирующее действие морской ВОДЫ на горные породы, металл, бетон и другие свойства морской воды. Одним словом, значение Н+ для морской воды не ниже, чем для крови и организма. Поражает несоответствие между ответственнейшим «постом» этой химической единицы и ничтожностью (сравнительной) ее количества в океане. Казалось бы, при столь низкой концентрации водородных ионов судьба их должна бы быть чрезвычайно подвержена’слепой игре геохимических, биохимических и дру-
гих обстоятельств. А раз [Н+] определяет течение химических и биохимических процессов, то и они в свою очередь, казалось бы, должны быть чрезвычайно нерегулярны и неопределенны. Действительно, при столь низкой концентрации водородных ионов достаточно, как это кажется. очевидным, добавить еще совсем немного водородных ионов в количестве, скажем, 1-Ю-8—ЫО-7 г на 1 л воды, и их концентрация изменится соответственно на один или два порядка (дальше, чтобы не утруждать себя нагромождением цифр, будем оперировать порядками без знака, т. е. показателями степени — это и есть pH, например, вместо [Н+] = 10-8 будем — просто говорить: порядок 8 или pH = 8). Итак, мы ждем изменения pH до 7 или 6 соответственно величине добавки. В действительности же мы с трудом заметим отклонение pH от 8 — настолько оно будет незначительным. Чтобы сдвинуть pH всего лишь на 2 единички, потребуется добавить водородных ионов (в виде кислоты) в миллион (!) раз больше, чем их имеется, т. е. в Черное море вылить половину Аральского моря из чистой соляной кислоты. Такого в природе не бывает. И то Черное море нужно изолировать, перелить в колбу, иначе все равно по известному нам теперь принципу эквифинальности через некоторое время pH снова выравняется до прежнего ста^ ционарного значения 8, если только мы не будем непрерывно и бесконечно выливать по ведру соляной кислоты, объемом в половину Аральского моря, изменив этим кинетические параметры системы. Заметим попутно, что для стационарности pH, как и других показателей, го’ раздо опаснее пусть и совсем небольшое, но непрерывное воздействие, т. е. изменение кинетических параметров, чем спорадический, пусть и гигантский катаклизм. Именно потому несущественны природные катаклизмы типа гигантских подводных вулканических извержений, выбрасывающих гигантскую массу того же водорода, но чрезвычайно опасно по своим последствиям непрерывное промышленное загрязнение океана, происходящее в настоящее время. От первого (но не от второго), как мы видели, природа выработала автоматическую систему защиты. ;
В защите такого микрокомпонента, как ионы водорода, важную роль играет рассмотренная выше мощная химическая карбонатная система автоматического регулиро-
вания, которая подключает на помощь к тому же ресурсы атмосферы и океанического дна. Эта система представляет собой, как мы видели, последовательность обратимо связанных химических процессов, изображенных на рис. 28. Если на подобную систему воздействовать извне, то, согласно принципу демпфирования, в системе усилится то из направлений процесса, течение которого ослабляет влияние произведенного воздействия. Это очень распространенный и надежный механизм саморегулирования pH растворов. В нашем случае, если мы добавляем водородные ноны, усиливается направление процесса, ослабляющее наше воздействие: равновесие смещается к левому краю, водородные ионы связываются в угольную кислоту Н2С03, увеличивается образование растворенного углекислого газа и вслед за этим—выделение его в атмосферу.
Видимо, важнейшим обстоятельством в «защите» водорода в океане является то, что морская вода — буферный раствор. Химики называют буферным раствором раствор с устойчивой концентрацией водородных ионов, с устойчивым pH, почти не зависящим от разбавления раствора и слабо изменяющимся при добавлении кислоты и щелочи
Буферные растворы—обязательная принадлежность всех химических лабораторий мира. Их составляют из раствора слабо диссоциирующей кислоты и ее соли. НСОз-, обладая рК = 11, является такой кислотой. Солей-бикарбонатов океану не занимать. Из этого в химической лаборатории океана и готовится, буферный раствОр. В чем механизм его действия?
Мы уже записывали условие равновесия диссоциации:
— [нсоз~] ‘ ■ ,
Поскольку океан многократно перестрахован, и наряду с карбонатным буфером в нем имеется много других— силикатный, боратиый, фосфатный и т.’ д., и даже ведется спор среди ученых—какой из буферов важнее, будем, записывать в общем виде условие равновесия,
изображая не конкретную кислоту и соль, а в общем виде —кислоту как НХ, а соль как MX (М —металл)
*=W— " <1W>
Соль MX диссоциирует очень сильно и настолько увеличивает концентрацию анионов X-, что, по принципу демпфирования, диссоциация самой кислоты практически полностью подавляется:
Поэтому практически [X-] = [MX], значит из (100) получим.
Если разбавить теперь морскую воду в 100 раз, то, поскольку и [НХ] уменьшится в 100 раз, и [MX] тоже уменьшится в 100 раз, [Н+], а значит и pH, почти не изменится. В действительности pH морской воды должен измениться на 0,1—из-за изменения степени диссоциации соли MX.
Точно таким же буферным раствором, как морская вода, оказывается и кровь.
Аналогии между морской водой и кровью распространяются, таким образом, не только на их состав, но и на механизмы регуляции состава, и даже на функциональную роль их важнейших компонентов: выше упоминалось о роли органических веществ; о роли ионов водорода мы рассказали только что; о роли растворенных газов приведем слова одного из крупнейших океанологов Харвея: «Ясно выступают два свойства морской воды, характеризующие ее как жизненную среду для растений и животных. Она содержит легко доступный запас угольной кислоты, подобно тому, как кровь содержит запас кислорода. Организмы могут забирать угольную кислоту из воды или отдавать ее в воду, и если эти изменения не выходят из известных пределов, то они вызывают лишь очень незначительные сдвиги в концентрации водородных ионов». Л
А если они все-таки вышли «из известных пределов», если бы, предположим невероятное, отказали бы надежные буферные системы? Посмотрим, как поведет себя океан, если, например, биомасса и активность организмов оказались бы огромными и их деятельность повлияла бы на pH слишком заметно, а буферная система отказала. ,
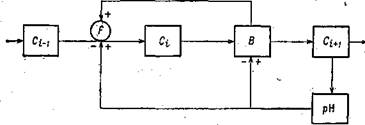
. Все биохимические процессы имеют узкий интервал оптимальных pH, ниже и выше которого pH резко тормозит работу ферментов F (рис. 34), разлагающих белки полисахариды и другие макромолекулы Сі-і до осколкої
|
Рис* 34. Блок-схема связей в системе: органические вещества — . ‘ , . микроорганизмы — pH. . ‘ — органические макромолекулы; — их осколки; мета болиты; В — микроорганизмы; F —выделяемые ими ферменты. • • — . • . j. |
Сі, служащих пищей микроорганизмам В, тормозит собственное развитие и жизнь организмов, подавляет ее. Таким образом, в критический момент срабатывают механизмы отрицательной обратной связи, обеспечивающие возвращение системы из возмущенного в «нормальное» состояние, обеспечивающие ее устойчивость. Причина, вызвавшая нарушение, буквально отомрет. Но все-таки предположим, что все перечисленные механизмы защиты pH отказали. Что случится? •
Океанические системы защищены от любых природных возмущений многократно, надежно, бесконечным числом связей, многие из которых могут взять на себя «всю полноту ответственности». Не случайно ученые называют все новые и новые связи и механизмы, которые, по их мнению, являются важными в регулировании pH в океане, Один из последних — взаимодействие со взве-
ями и донными осадками типа глин, которые являются онообменниками. Например: •
1,5 Al2Si205 (ОН)4 + К+ Ь KAlgSigOjo (ОН)2 +
*+ ‘ . + Н++1.5НА.
словие равновесия: ‘
Значит, несмотря на наше воздействие, концентра — ия ионов водорода все равно будет находиться в по — гоянном соотношении с концентрацией, калия в морской оде. Учитывая огромные запасы К+ в океане, очевидно, го нарушить постоянство состава морской воды не дастся. ‘
Подобные условия равновесия можно записать и с ругими ионами металлов. Таким образом, в «защите» :+ принимает участие большинство компонентов мор — хой воды. ;
В последнее время этот механизм предлагается как эсьма важный механизм регулирования pH в океане, э крайней мере в глубинных водах, как pH-стат. Это іедовало бы рассмотреть подробнее. .
Однако нам важно другое — то, что океа>н отвечает а любую попытку внести возмущение как единое целое, гкликается и «защищается» реакцией’ всех элементов, эдключая одновременно и химические, и физико-хими — зские, и геохимические, и биологические механизмы шорегулирования, подключая также «ресурсы» атмо — [>еры и дна — т. е. биосферы в целом. Отвечает как южная, но единая Динамическая система и одновре — енно как звено более сложной системы^-Биосферы.