Вода ли морская вода? Сложные системы
Вода ли морская вода? Сложные системы
Казалось бы, здесь все известно, «дом» этот — вода, НгО. Строение, свойства и взаимодействия воды с другими • веществами и природными объектами хорошо известны, и ничего нового открыться нам не может. Но вот, например, геологи до недавнего времени считали, и это, представлялось воем нам бесспорным со школьной скамьи, что разрушение горных пород происходит вследствие замерзания воды в порах — аналогично тому, как лопается закрытая бутылка с замерзающей водой. И только сравнительно недавно геологи установили что замерзание не имеет никакого значения— главную роль играет просто переупорядочивание молекул воды, адсорбированной на кристаллах (но не замерзшей), при колебаниях температуры. Точно так же могут разрушать породу и другие жидкости, состоящие из полярных молекул, т. е. имеющих разноименно заряженные полюсы. Например, диметилформамид, молекула которого полярна, разрушает породу через 5 циклов нагревания До +85° С и охлаждения до 4-20° С. В то время как четыреххлористый углерод, молекула которого неполярна, не. действует таким
1 Chern. Eng. News., 1966, vol. 44, N 8, p. 102.
образом. Четкое, наглядное и «понятное» представление о процессе приходится менять на нечто, как кажется, неопределенное и туманное. И самое неприятное— значит, нет гарантии, что и другие, не менее четкие и наглядные представления не подвергнутся со временем подобной же ревизии. ‘
Пример этот поучителен ещё в одном отношении. Совершенно незначительные, на первый взгляд, мелкомасштабные детали могут привести к крупным, глобального значения, последствиям. Микроскопические, на молекулярном уровне, особенности и взаимодействия, являющиеся предметом интереса химии, вызывают макромасштабные, геологического уровня, , процессы. Между тем даже в наш атомный век человеку свойственно видеть причину гигантских природных явлений в не менее гигантских и масштабных источниках и действиях. Учитывая это, рассмотрим кратко строение молекулы воды и структуру воды, обращая внимание не столько на хорошо известные из химии факты, сколько на те микроскопические особенности, которые, на наш взгляд, могут оказаться, существенными для представления о том, что же такое морская вода.
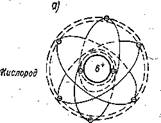
Элементы, из которых построена молекула воды, — кислород О и водород Н — порознь представляют собой элементарные электростатически сбалансированные системы, — схемы которых изображены на рис. 21 а. Сведенные в одну молекулу два атома водорода и один атом кислорода (рис. 21 б) формально ничего нового не приобрели и не потеряли: их суммарная масса и взятых порознь, и сведенных в молекулу равна 18 атомным единицам, число элементарных частиц — протонов, электронов и нейтронов — тоже одинаково. Однако по свойствам и по своей сути — это не просто сумма 2Н и О, а некоторым образом упорядоченная устойчивая система из двух Н и одного О, элементы которой определенным образом взаимосвязаны и организованны в нечто новое — молекулу воды. Такое характерное свойство систем — качественное отличие их от суммы составляющих их элементов — называют эмерджент-
НОСТЬЮ.’ ‘
Из-за того что атом водорода отдает «свой» единственный электрон на образование молекулы воды, протон — ядро водорода — оказывается «голым», нг
|
В°д0Р°д |
|
|
r®
®/——-
/
/
Рис. 21.
а— атомы кислорода — и водорода; б—-молекула, воды и ее электронные орбиты; в —4 полюса зарядов в молекуле воды, расположенные в вершинах тет — • раэдра (проекция на плоскость).
|
|
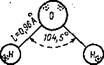
прикрытым никакой электронной оболочкой. Он подтягивается очень близко к электронной оболочке кислорода. и в какой-то степени внедряется в нее. Электроны в среднем оказываются больше смещенными, в сторону кислорода, молекула воды становится полярной, обладающей двумя разноименно заряженными полюсами, т. е. диполем: эффективный заряд при водороде +0,33, а при кислороде —0,66. Геометрическое
|
|
|
Вода Лед. Рис. 22. Геометрическая модель молекулы воды. |
|
|
строение молекулы воды изображено на рис. 22. Значения геометрических характеристик связаны с агрегатным состоянием воды.
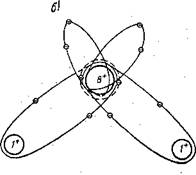
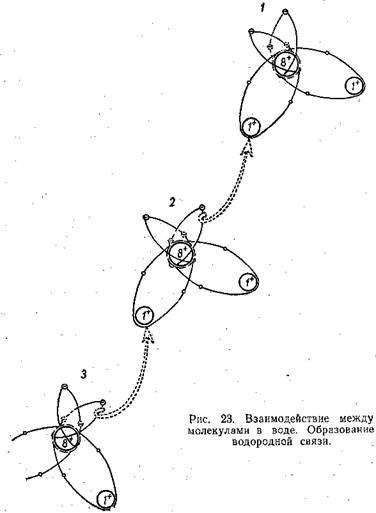
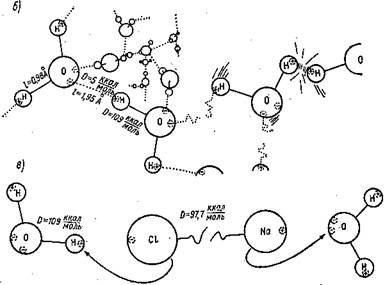
, Проследим за дальнейшим переходом от молекулы воды к воде как реальному, веществу, т. е. к совокупности огромного количества молекул воды. Как и в случае любых других газообразных и жидких веществ, молекулы воды будут находиться в беспорядочном, хаотичном тепловом движении, тем более беспорядочном, чем выше температура. Однако электростатическое междипольное взаимодействие противодействует беспорядочному тепловому движению молекул и стремится ориентировать их совершенно определенным образом, при этом, как показано на рис. 23, протон одной молекулы воды (№ ^взаимодействует с электронами другой молекулы воды (№ 2), протон которой в свою очередь может взаимодействовать с электронами молекулы № 3. В результате связь в самой молекуле № 2 будет поляризоваться еще больше, что в свою очередь приведет к. еще большему усилению связи между молекулами и т. д. Образуется так называемая водородная связь. Она очень слаба. Достаточно энергии 5—6 ккал на 1 моль вещества, чтобы разорвать ее. Для разрыва связи в самой молекуле воды такая минимально необходимая энергия (энергия связи D) почти в 20 раз больше, Dji-o = 109,4 юкал/моль воды. И все же благодаря междипольному взаимодействию и главным образом водородной связи молекулы воды противопоставляют хаосу теплового движения стремление к определенной упорядоченности в пространстве и, во времени и к образованию агрегатов, ассоциаций молекул воды из двух, трех и даже из четырех молекул. Насколько это им удается, зависит от температуры. Но если проследить за любой молекулой воды, то окажется, что Совершенно «упорядочиться» ей не удается. Ассоциации молекул возникают лишь на какое-то мгновение — тепловое движение и столкновения с другими молекулами практически мгновенно их разрушают, они снова на какое-то время образуются в другом месте. Если бы удалось сфотографировать картину в целом, то на фотографии. мы не увидели бы той упорядоченной структуры, которую рисуют в книгах и учебниках ^рис. 24 а), чтобы создать представление о тенденции,
на которую надо обратить внимание. Существует ли некоторая определенная структура воды реально? Пе^ ресчитав на «мгновенной» фотографии расположение
|
|
|
Рис. 24. Взаимодействие между молекулами в воде. с — упрощенное изображение водородной связи в воде; б — среди беспорядочно движущихся молекул воды непрерывно происходит образование и разрыв водородных связей; в — разрыв связей (диссоциация) в молекулах электролитов в воде. D — энергия связи (ккал/моль); /—расстояние между ядрами кислорода и водорода (А — ангстрем = 10-® см) внутри одной молекулй и между разными молекулами, связанными в двойной ассоциат. |
|
|
^миллионов молекул и статистически проанализировав результат, можно обнаружить, что в среднем каждое мгновение больше чем половину молекул можно считать связанными в ассоциации, расположение которых
в пространстве небеспорядочно и напоминает фантастический натянутый каркас из паутины, во всех местах то и дело рвущейся, но самовосстанавлаваю — щейся (рис., 24 б). Даже при температуре выше 100°С, когда энергия теплового движения велика, плотность
|
|
водяного пара такова, как если бы в среднем 3,5% молекул существовало в виде ассоциации (Н20)2.
— Имеют ли значение столь слабые взаимодействия, есть ли какой-либо реально ощутимый эффект эмерджент — ности этой системы? Другими словами: есть ли какая — нибудь ощутимая разница в том, представляет ли собой вода определенным образом организованную совокупность взаимодействующих элементов, т. е. систему, или это просто огромное количество молекул Н2О? Таблица Менделеева позволяет Н20 H2S H2Se Н2Те рассчитать свойства и со-
О S0 100 стояние «воды», не обла-
Молекулярная масса » »
у ґ дающей присущими ей
Рис. 25. Сравнение действи — структурными особенностя-
тельных температур фазовых ми. Для этого. нужно экс-
переходов воды с ожидаемыми траполировать характери-
по аналогии с другими гидри — г. г гг
Дами VI-А группы периода — стики химических аналогов
ческой / системы элементов воды, соединений водорода
Менделеева. Эффект эмерд — с элементами той же ПОД. ■* , жентности. группы, что и кислород (та-
1 ■+- температура кипения; — тем’ Vv’ пература плавления. . КИМ ПуТбМ В СВ06 Врб-МЯ
Д. И. Менделеевым были точно предсказаны свойства некоторых еще не открытых веществ). Результаты такой экстраполяции хорошо известны.
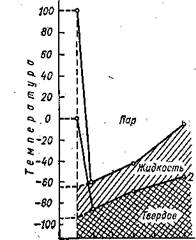
Они приводятся на рис. 25. Температура плавления воды вместо 0 °С должна бы быть равна —95 °С, ■а температура кипения вместо 100 °С должна быть около —65 °С. Значит, если бы вода была «нор
мальным» веществом, без водородных связей и обусловленной ими упорядоченности, она существовала бы на Земле только в виде пара, как сероводород, и только где-нибудь в Якутии выпадала бы иногда зимой в виде дождя. Впрочем, весь температурный режим поверхности нашей планеты был бы иным. Да и Якутия не имела бы названия, поскольку не было бы людей и вообще живых организмов. Но допустим, что вопреки всему вода все равно замерзала бы при 0° С, кипела при 100° С и существовала бы на Земле одновременно в трех фазовых состояниях — парообразном, жидком и твердом, как это, по-видимому, требуется для возникновения и существования жизни в том виде, в каком мы ее знаом. Однако теплоемкость воды была бы «нормальной», значительно ниже действительной, и тогда Землю лихорадило бы: температура то очень быстро поднималась бы до +100° С и вся масса воды испарялась бы, то так же быстро температура падала бы, местами ниже —100° С, и океан превращался бы в лед, потому что. плотность льда была бы выше плотности воды, как и положено нормальному веществу, и все новые и новые массы льда опускались бы на дно. Растворенные вещества выморозились бы из воды. Впрочем, их почти не было бы, так как вода в этом случае не была бы таким универсальным растворителем. Одним словом, выстроенный нами дом немедленно рухнул бы.
Рассмотренные особенности воды как сравнительно простой системы дают повод сформулировать некоторые свойства систем, хорошо известные из соответствующей специальной области науки—общей теории систем (пока мы вынуждены иметь в виду лишь некоторые свойства, характеризующие системы закрытые, т. е. без обмена с окружающей средой, и не динамические, т. е. такие, в которых время не играет роли). •
. 1. Элементарные системы, если они взаимодей
ствуют друг с другом, образовывают единую, устойчивую, более сложную систему, которая в свою очередь оказывается более простой, подсистемой, по отношению к еще более сложной охватывающей ее системе. Обозначая предложение: «Л включает в себя ■ В» символом йс/1, можно для наглядности, записать: II, О с с: Н20 cz вода. . ; : — :
2. Системы, являясь организованной совокупностью взаимодействующих элементов, обладают свойством ;эмерджентноети. Для наглядности можно записать: Н20^=2Н + 0; вода Ф яН20.
3. Структуру системы, т. е. образующие ее элементы с отношениями и связями между ними, нельзя непосредственно увидеть или сфотографировать, но Она реально существует, проявляется в свойствах и реакциях системы и потому может быть изучена и символически изображена. Определенной характеристикой структуры системы могут-служить принятые в химии представления о структуре (строении) химических объектов:
1) структуры, связанные с модельными представлениями (например, электронная структура атома, рис. 21);
2) структуры, связанные с геометрическими представлениями (например, кристаллы, или геометрическое представление на рис. 22); 3) структуры, связанные с кинетическими представлениями (например, возникающие в течение химических реакций или в растворах, рис. 23). Однако принятые в химии (строение)-и в теории систем (функциональные) понятия структуры не тождественны.
, 4. Структура системы и ее поведение, функциониро
вание, тесно и определенным образом связаны между собой.
5. Даже слабые взаимодействия и мелкомасштабные элементы и процессы в системе могут определять ее облик И поведение. ;
6. Из изложенных сведений можно сделать общие выводы относительно возможностей и путей изучения систем. Вследствие эмерджентности знания об элементах системы, даже детальные, не могут дать знания о системе. Простое объединение сведений об элементах системы может дать лишь ложное представление о ней.
Поскольку структура и функционирование системы однозначно связаны, поведение и состояние системы, вообще говоря, может быть предсказано из детального знания ее структуры, в этом смысле оно предопределено, детерминировано, Однако построение абсолютно точной детерминистической модели (основанной на причинно-следственных связях) хоть сколько-нибудь сложной системы практически невозможно: в системе из п элементов существует п(п—1) возможных связей и
>бщее число состояний s ^ 2п(-п~1 т. е. фантастически 5ЄЛИКО. Так, в системе всего лишь из 10 элементов возможно 90 связей и s ^ 290 = 1,3 • 1027 состояний. Если ^следование каждого из этих состояний проводить 5ыстрее, чем мгновенно, например за одну миллионную юлю секунды, то на такое изучение системы даже при їепрерьівной работе потребуется больше времени, чем существует Земля. Поэтому в системе выделяют лишь ‘лавные связи и пренебрегают второстепенными. Одна — со это очень рискованная процедура, не допускающая юлюнтаристоких решений, так каїк даже слабые взаимодействия и связи могут определять поведение системы. Детерминистические исследования должны сочетаться с расчетами статистическими и вероятностными (стохастическими). —
Знание системы можно считать точным и полным, гели удается дать — точный долгосрочный прогноз ее состояния и если в то же время удается рассчитать состояние любого элемента по данным о состоянии п—1 эстальных ее элементов. Ярчайшие примеры такого зна-1 дия системы неоднократно демонстрировала небесная механика. Ее пример вселяет уверенность в принципиальной возможности познания сложных систем.
В химии океана наиболее полно системные представления нашли стихийное отражение во взглядах на карбонатную систему, в развитие которых весомый вклад внес крупнейший советский гидрохимик О. А. Алехин. Однако именно морская вода в целом, океан как химическая система, только начинает изучаться. Поэтому наши дальнейшие выводы будут пока менее определенны, мы больше поставим вопросов, чем ответим на них. : •
Прежде всего, учитывая уже разобранные вопросы* можно было бы довольно точно предсказать, как должна взаимодействовать вода с теми веществами и эбъектами, с которыми она может прийти и приходит в контакт, какую систему они образуют. Значит состояние этой системы не случайно, а. предопределено, как предопределено свойствами элементарных систем Н и О состояние образуемой ими воды. Все события и встречи, которые могут произойти, как бы накладываются на матрицу упорядоченности воды • и согласовываются с силами, обусловливающими эту упорядоченность.
Хорошо известно, что электролиты диссоциирую’ в воде: те же СИЛЫ, 0 ‘Которых говорилось выше, бук вально разрывают на части полярные молекулы, напри мер Nad, несмотря на высокую энергию связи в ней равную 97,7 ккал/моль (см. рис. 24 в). Образовавшиес? разноименно заряженные ионы Na+ и С1_, естественно стремятся снова соединиться в молекулу (это и, м почті — не удается):
… NaCl—>N;f;- + C|-.
Диссоциируют и неорганические соединения угле рода: ,
Н2С03?=Ш+ + НС0^; HCCV Н++ С02-
Гораздо меньше известно, что происходит с самої водой под влиянием растворенных в ней веществ. Знаі свойства систем, можно уверенно сказать, что раство ренные вещества должны в свою очередь повлиять ні структурные характеристики воды. Действительно, экс периментально обнаружено что ионы Al3+, Cd2+, Zn[22]+ Mg2+, Na+, S042-, CO32-, OH-, F — приводят к упорядо чению структуры воды вблизи иона, а К+, I~, ГЮз — Cl — —к ее разрыхлению. Растворение органических ве ществ может влиять на структуру воды в еще большеі степени: Может ли это привести к заметным изменениям в системе? Очевидно, может, но экспериментально ЭТ( изучалось мало. Обнаружено, что углеводороды, напри мер, настолько способствуют^ упорядочению структурь воды, что она при нормальной, «комнатной», темпера туре в местах контакта с большой органической моле кулой превращается в маленькие айсберги, которые по лучили название «айсберги Франка—Эванса» — по име ни открывателей. Из-за структурных же сдвигов в вод« в ней аномально низка растворимость газов по сравне нию с их растворимостью в органических жидкостях причем эта растворимость зависит от солености воды По этой же причине в морской воде, особенно при боль ших давлениях (до 1500 кг/см2), наблюдается вязкость шомальная по сравнению с вязкостью «просто воды». Цаже взвешенные в. морской воде вещества должны ока — іьівать заметное влияние, так как вблизи поверхности твердого тела, из-за ориентирующего действия поверх — юсти, структура жидкости упорядочивается, причем тол — дина таких упорядоченных слоев порядка 10~6 см, т. е: эгромна по сравнению с размерами молекул воды. Свойства таких слоев специфичны, в частности они обладают повышенной вязкостью.
Здесь не случайно подчеркивается именно это свойство —вязкость морской воды — она влияет на гидродинамические свойства жидкости. Нет ни одного свойства, по которому вода и морская вода были бы полностью идентичны — начиная температурой кипения и плавления и кончая кинетикой реакций и термодинамикой процессов, протекающих в ней. Если выражать эти различия в цифрах, то они могут показаться столь малыми, что, не зная особенностей сложных систем, мы не стали бы принимать их во внимание. Но мы уже подчеркивали как чрезвычайно важное свойство систем то обстоятельство, что мелкомасштабные составляющие ее элементы и взаимодействия между ними могут кардинально влиять на облик всей системы,- «Мелкие», казалось бы, структурные особенности морской воды, обусловленные взаимодействием с растворенными в ней веществами, приводят к уже «заметным» отличиям ее от воды-: плотность последней максимальна при 4°С, в то время как морская вода уплотняется до самой температуры замерзания. Это отличие приводит уже к «масштабным» гидрологическим последствиям: в воде при температуре ниже 4°С прекращается термическая конвекция, а в океане она протекает благополучно при любых низких температурах (так называемая осенне-зимняя конвекция). Это в свою очередь имеет «гигантские», глобальные последствия — климатообразующие и другие географические, формирует определенную химическую структуру морей и океана — в них не прекращается вентиляция глубин кислородом, а верхние слои, бедные морскими удобрениями (биогенными элементами — Р, N,- Si), обогащаются ими. Поскольку в системе все сказано, не заставляют себя ждать и биологические последствия наступает осенняя вспышка жизни, не свойстрен: пая суше. ■ -…………………………….. —
Таким образом, морская вода, как более сложная си стема, отличается от воды составляющими ее компонен тами и структурой, и, как внешнее’ проявление этоп различия, наблюдаются различия физического, химиче ского, биологического и даже географического харак тера. Больше того, даже ставя специально такую цель не удается получить искусственную морскую воду, иден тичную по свойствам морской. И так же как для переливания крови пока приходится пользоваться толькі естественной кровью, для морских аквариумов не удает ся получить искусственную морскую Воду, пригоднук для длительной-и нормальной жизни организмов, дажі не нуждающихся, как принято думать, в растворенны; в морской воде веществах —например, для жизни акул Можно повторить вслед за геологами, иногда называю щими морскую воду минералом, «что константы, полу ченные при изучении так называемых чистых растворов не всегда выдерживаются в случае сложного многоком понейтного соединения, каким Является морская вода» [23] и, показав, что вода и морская вода — не идентичны* системы и что вторая несравненно сложнее и включаег первую, записать: Н20 сг вода с морская вода.
Можно было бы остановиться на том, что, по-видимому, правы Силлен[24] и Мэккинчер[25], рассматривающие морскую воду не как 1 л воды, в которой содержится 19,8 г ионов С1-, 11 г ионов Na+, 1 мг органических веществ, 6 мл кислорода, 0,1 мг взвесей и т. д., а как систему, образованную множеством составляющих ее элементов, из которых наиболее заметные представлены на гистограмме Мэккинчера (рис. 26). Действительно; не рассматриваем же мы кровь или медузу как воду, в которой растворено и взвешено или находится в коллоидном состоянии определенное количество определенных веществ или элементов, хотя, например, от выбро1 шенной на берег медузы, когда она высохнет на солнце и испарится вода, Остается только тонкая пленка, напоминающая. полиэтиленовый пакетик. При испарении
1 л морской, воды остается около 35 г сухого остатка — фактически столько же, сколько и от медузы.
Гистограмма говорит, правда, тоже только о количественном составе. Интереснее составленная геохимиками специальная, так называемая периодическая таблица морской воды (рис. 27), которая показывает, в каком преимущественно виде существуют образующие эту систему химические элементы и как это связано с электронной структурой (с заполненностью так называемых е?-орбиталей). Каждый квадратик в таблице — отдельная «семья» соединений одного элемента, представленная здесь лишь «главой», так сказать, «ответственным квартиросъемщиком». Понятно, что на полное описание всех не хватило бы и огромной книги — потому нами и выбрана одна «семья».
. Однако мало сказать только, что морская вода представляет собой сложную химическую систему, многокомпонентную, гетерогенную[26], единую и определенным образом упорядоченную, обладающую набором всех свойств, присущих сложным системам, что структура и поведение этой системы, тесно связанные между собой, предопределены свойствами образующих ее элементов— воды и в с е х природных объектов, с которыми она взаимодействует. ‘
Гораздо интереснее разобрать следующие три вопроса, связанные с переходом от рассмотрения простых систем ко все более сложным.
1. Есть ли особенность перехода от систем сравнительно простых к сложным, от атомов Н и О к молекуле Н20, от отдельных молекул Н20 к вёществу^«вода» (т. е. к ансамблю молекул) и от нее к йорской воде? К какому переходу мы должны быть готовы дальше и в чем может заключаться особенность этого перехода?
. При переходах от элементарных систем к более сложным, но простым, низкого порядка, нам удавалось выделить один существенный фактор, например, водородную связь. При переходе к сложным системам это сделать трудно, определяющим является весь комплекс.’ Наконец, при переходе ко все более сложной системе внешнее отличие ее от подсистем не столь резко
бросается в глаза, потому что это отличие уже лежит t другой плоскости свойств, нежели отличия, В ОСНОВНОЇ касающиеся физических свойств, при переходах межд более простыми системами. Ее сложность и одновремен но единство, однородность и одновременно упорядочен ность, существование элемента как самостоятельной еди ницы и как части системы — приблизительно такого род; вопросы становятся существенными. Причем мы пок; имеем возможность оставаться в рамках чисто хими ческих представлений и понятий. При переходе к мор ской воде уже обозначается необходимость выйти за зті рамки. Очевидно, что особенностью перехода к следую щёй более сложной системе будет конструирование ЄІ как единого целого из подсистем, отражающих различ ные формы движения материи, — не только химических но и биологических, физических, механических. Эта си стема — океан в целом.
2. Мы ограничивались учетом только химических эле ментов и факторов в системе. Будет ли сконструирован ная таким образом, пусть даже и сложная, систем? адекватна природной, даже если не касаться океана і целом? Например, будет ли приготовленная нами точне — по природному рецепту морская вода тождественш пробе морской воды, хранящейся в склянке, и в свок очередь будет ли последняя тождественна морской воде находящейся в природной обстановке, в океане? И ин туиция, и опыт, и общие положения теории систем ПОД’ сказывают, что нет, все они не тождественны. Насколькс же связаны и взаимообусловлены нехимические и химические факторы? Прежде всего, как хорошо известно химия морской воды неотделима от ее биохимии и биологии и наоборот. Мйллйоны микроорганизмов, которые можно обнаружить даже в 1 мл морской воды, непрерывно поглощают из нее и выделяют самые различные органические и неорганические вещества, обрабатывая массу, в сотни раз превосходящую собственный вес, выбрасывая 70% обработанного продукта снова в воду, откуда он вновь утилизируется другими организмами. Структура системы без учета такого элемента, конечне же, не реалистична.
Меньше известно о взаимосвязях с физическими факторами, хотя в технике и медицине, например, используется влияние электромагнитного поля на структуру и
свойства водных систем, а в геофизических методах поиска водных источников, наоборот, используется влияние водных масс на электромагнитное поле.
Еще хуже описаны взаимосвязи с механическими — гидродинамическими факторами. Учитывается только влияние солености (через плотность) и вязкости морской воды. Именно поэтому мы подчеркивали связь вязкости со структурными особенностями системы. Можно ожидать много интереснейших открытий на пути изучения того, как влияет на гидрологическую картину океана структура системы и структурно-организационные «мелочи», в том числе химической и биологической природы. На первом Всесоюзном семинаре по моделированию морских экологических систем внимание участников привлек доклад член-корр. АН УССР В. И. Беляева[27] о модели, в которой учитывается, что пространственная структура и плотность популяций микроорганизмов могут влиять на поглощение солнечной радиации и через это — на гидрологические особенности верхнего слоя моря. ‘
Однако есть и обратное,’тонкое по своей природе, воздействие, которое химики пока не учитывают ни при изучении настоящего, ни’ при изучении прошлого океана. Движение жидкости— один из самых распространенных. факторов, воздействующих на распределение находящихся в жидкости частиц, в том числе микроорганизмов и больших молекул. Рассмотрев влияние пространственной упорядоченности на — свойства систем, мы теперь можем оценить значение и. последствия этого тонкого воздействия. Говоря выше о том, как электростатические факторы накладываются на тепловое движение молекул, мы видели, к каким поразительным последствиям. это приводит. Гидродинамические факторы тоже накладываются на тепловое движение молекул, и состояние молекул, особенно крупных, оказывается зависящим от их формы. Стержнеобразная частица, в том числе большая молекула, в ламинарном потоке вращается с некоторой угловой скоростью, которая придает преимущественную устойчивость определенным угловым положениям, т. е. происходит ориентация частиц, сказывающаяся на пространственной структуре системы. Если эти частицы могут образовывать химические связи, то эти связи и строение образовавшегося продукта могут зафиксировать расположение, созданное гидродинамическим потоком. «Можно предположить, что сложные структуры биологических систем носят на себе некоторый отпечаток создавших их гидродинамических потоков». «Возможно, что они способствовали закручиванию молекул биополимеров в спирали»Если это так, то со временем мы прочтем гидродинамику древнего океана, изучив молекулы биологических полимеров.
. Но это со временем. Сейчас пока интересы ученых сосредоточены на том, чтобы описать связь кинетики реакций с гидродинамикой пОтока.
3. Почему, несмотря на то, что молекулы различных веществ, попадая в воду, претерпевают самые различные изменения: простые, как диссоциация NaCl, или посложнее, как диссоциация Н2СО3, представляющая собой целую цепь обратимых реакций, или еще более сложцые, на которые влияют биОлогич-еские, физические и гидро— механические процессы, почему, несмотря на интенсивное течение этих процессов, концентрации различных химических веществ в морской воде меняются мало? :
Чтобы ответить на этот важный вопрос, необходимо остановиться на том, что морская вода (даже хранящаяся в закрытой колбе) — не просто Сложная система, а система динамическая. ■