 КОНЦЕНТРАЦИЯ ВОДОРОДНЫХ ИОНОВ рН
КОНЦЕНТРАЦИЯ ВОДОРОДНЫХ ИОНОВ рН
Наличие в промывочной жидкости водородных ионов связано с процессом диссоциации воды, являющейся слабодиссоциирующим веществом: в 1 л при 22 °С диссоциирует 1•10-7 моля с образованием 1•10-7 моля водорода Н+ и 1•10-7 моля гид-роксидной группы ОН. Концентрацию диссоциированных молекул Н2О в воде и разбавленных водных растворах можно считать величиной постоянной. Произведение концентраций водородных и гидроксидных ионов, так называемое ионное произведение воды, также постоянно. Численное значение его при 22 °С равно 1•10-14.
Если в водных растворах концентрация водорода и гидроксидной группы одинакова (каждая равна 1•10-7 моль/л), такие растворы являются нейтральными. В кислых растворах концентрация водородных ионов превышает 1 • 10-7 моль/л, в щелочных растворах концентрация ионов гидроксидной группы больше концентрации водорода.
Кислотность и щелочность раствора можно выражать либо через концентрацию ионов Н+, либо через концентрацию ионов ОН-. На практике для этого обычно пользуются концентрацией Н+.
Чтобы избежать неудобств, связанных с применением степенных отрицательных чисел, концентрацию водородных ионов принято выражать ее логарифмом с обратным знаком и называть водородным показателем рН= — lg[H+].
В нейтральных растворах рН =7, в кислых рН<7 и уменьшается с ростом кислотности. В щелочных растворах рН>7 и повышается с увеличением щелочности. Концентрация водородных ионов рН — важный показатель, определяющий характер физико-химических процессов в промывочной жидкости и необходимость обработки ее реагентами. В каждой дисперсной системе при определенных значениях концентрации водородных ионов наступает максимум и минимум стабильности.
Для различных промывочных жидкостей существует своя оптимальная концентрация водородных ионов, при которой они наиболее полно удовлетворяют требованиям технологии бурения в конкретных геолого-технических условиях. Контроль за величиной рН позволяет определить причины изменения свойств промывочной жидкости в процессе бурения и принять меры по восстановлению ее качества. Концентрацию водородных ионов промывочных жидкостей измеряют колориметрическим и электрометрическим способами.
Колориметрический способ Основан на применении индикаторов. При этом способе используют наборы индикаторов и буферных растворов различных реактивов с определенными значениями рН. Фильтрат, полученный при измерении водоотдачи, наливают в пробирку, добавляют в нее раствор индикатора и сравнивают цвет жидкости в этой пробирке с цветом эталонных буферных растворов с индикаторами или с эталонной цветной шкалой, на которой указаны значения рН, соответствующие той или иной окраске.
Более удобен колориметрический способ измерения рН с использованием набора индикаторной бумаги и эталонных цветных шкал. При измерении полоску индикаторной бумаги осторожно укладывают на поверхность промывочной жидкости. Когда полоска пропитывается жидкостью и цвет ее перестанет изменяться, прикладывают ее к эталонной шкале и по шкале определяют величину рН, соответствующую данной интенсивности окраски. Если подобрать подходящий цвет по шкале не удается, это значит, что сорт бумаги был выбран неправильно, опыт нужно повторить, взяв соответствующую бумагу, Колориметрический метод имеет невысокую точность (+0,5 рН) и чаще применяется в полевых условиях.
Электрометрический способ Используется для более точного определения рН в лабораториях на специальных приборах рН-метрах, например рН-262. Здесь для измерения величины рН используется система со стеклянным электродом, электродвижущая сила которой зависит от активности ионов водорода в растворе.
Схема прибора для измерения рН приведена на рис. 29. Стеклянный электрод 2 Представляет собой трубку с полым шариком 1 из специального стекла на конце. При погружении электрода в раствор между поверхностью шарика электрода и раствором происходит обмен ионами, в результате которого ионы лития в поверхностных слоях стекла замещаются ионами водорода и стеклянный электрод приобретает свойства водородного электрода.
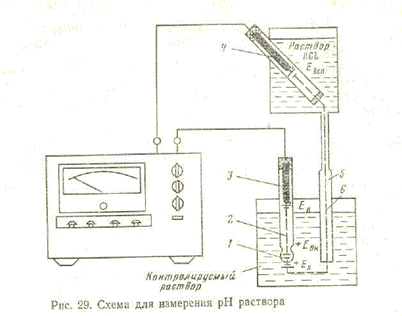
Между поверхностью стекла и контролируемым раствором возникает разность потенциалов, величина которой определяется активностью ионов водорода в растворе. Для создания электрической цепи при измерении применяются контактные электроды: внутренний контактный электрод 3, осуществляющий электрический контакт с раствором, который заполняет внутреннюю полость стеклянного электрода, и внешний контактный электрод (вспомогательный электрод) 4, осуществляющий электрический контакт с контролируемым раствором.
С целью защиты от воздействия высоких температур (при измерении рН растворов, температура которых выше температуры окружающего воздуха) вспомогательный электрод помещают вне контролируемого раствора и соединяют его с последним при помощи электролитической трубки 5 (ключа), наполненной раствором хлористого калия и заканчивающейся пористой перегородкой 6.
Раствор хлористого калия непрерывно просачивается через пористую перегородку, предотвращая проникновение из контролируемого раствора в систему электрода 4 посторонних ионов, которые могли бы изменить величину эдс электрода.
Для измерения эдс электродной системы применяется компенсационная схема, позволяющая существенно уменьшить потребляемый ток электродной системы при измерении. Электродвижущая сила Е электродной системы сравнивается с падением напряжения на сопротивлении, через которое протекает ток конечного каскада усилителя рН-метра. Этот ток пропорционален эдс электродной системы, а следовательно, и величине рН контролируемого раствора.
Прибор позволяет выполнить измерения рН с точностью до 0,01 единицы.