ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ КОЭФФИЦИЕНТОВ ДИФФУЗИИ КВАРЦЕВОГО ПЕСКА И ВОДНОГО РАСТВОРА ПОРТЛАНДЦЕМЕНТА
ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ КОЭФФИЦИЕНТОВ ДИФФУЗИИ КВАРЦЕВОГО ПЕСКА И ВОДНОГО РАСТВОРА ПОРТЛАНДЦЕМЕНТА
Обычно коэффициент диффузии дисперсного тела определяют из выражения
Di = 82О0,
где 62 — пористость дисперсного тела; Do — молекулярный коэффициент диффузии данного раствора соли.
В работе [Шехтер Р., 1971 г.] получено выражение, которое ограничивает коэффициент диффузии электрически нейтрального тела сверху:
, £)2<8г£)о[1—(1 —в2)/3].
Таким образом, коэффициент диффузии находят из приближенных теоретических выражений, которые справедливы для дисперсных тел
|
65 |
5 Заказ 1935
с электрически нейтральной поверхностью. Но на коэффициент диффузии существенное влияние оказывает электрическое взаимодействие с поверхностью твердой фазы. Согласно теоретическим положениям физической химии на коэффициент диффузии влияет концентрация электролита. Обычно с ростом концентрации электролита электрокинетический потенциал падает и система переходит в изоэлектрическое состояние. Параллельно этому происходит снижение коэффициента диффузии до минимального значения. В последнее время также обнаружено, что электрокинетический потенциал существует и в дисперсиях с высоким содержанием электролита, т. е. зависимость потенциала от концентрации имеет немонотонный характер.
Ниже представлены результаты экспериментального определения коэффициента диффузии в широком диапазоне концентраций. Суть использованного метода заключается в следующем. Испытуемый материал — кварцевый песок или водный раствор портландцемента (среда 1) помещается в нижнюю часть вертикально расположенного цилиндрического сосуда. Поровое пространство заполняется жидкостью с равномерной начальной концентрацией ионов. Над испытуемым материалом размещается эталонная среда 2 — жидкость с более низкой концентрацией ионов. В момент соприкосновения сред 1 и 2 начинается процесс диффузии, т. е. в контактирующих системах формируются нестационарные поля концентрации. Среды 1 и 2 считаем полуограниченными, поэтому продолжительность эксперимента выбираем такой, чтобы диффундирующие ионы не достигали нижней и верхней границ испытуемой и эталонной сред.
Расположим начало координат на границе контактирующих сред, а исходную концентрацию ионов в среде 2 примем за начало отсчета. При математическом описании процесса считаем, что для каждой из двух сред справедливо обычное диффузионное уравнение
dCi д*с,
TOC o "1-5" h z ~дГ~ Dl~dT~’ (41)
где С/, Di, t их — концентрация, коэффициент диффузии, время и координата; i — среда.
Краевые условия имеют вид
х = 0, />0 DxdCiJdx = DtfCi/dx, С, = С2; (4.2)
х<0, t = О С| = Со и х>0, t = О С2 == 0, (4.3)
где Со — избыточная начальная концентрация ионов в поровом объеме дисперсного тела.
Используя результаты работы [69], решение задачи (4.1) — (4.3) для среды 2 записываем в форме
. C2(x, t) = C0D{ 1 —erf[x/(2 /5J)]}, (4.4)
где D= fD/(VD+ /D2); erf [x/(2/Dlt)] — интеграл вероятности.
Элементарную массу ионов, поступивших в среду 2, найдем из выражения
дС2 I ‘ dm = Di-j^-Sdt I х=о, (4.5)
где 5 — площадь контакта сред 1 и 2.
Подставляя выражение (4.4) в (4.5) и интегрируя в пределах от О до /, с использованием правила дифференцирования определенного интеграла по параметру получаем
TOC o "1-5" h z т = 4SC0D2Dt/ /4nD2t. (4.6)
С другой стороны, правую часть выражения (4.6) можно представить в виде.
т = ACSR(t). (4.7)
Здесь АС — изменение концентрации данного иона в эталонной среде за время массообмена.
В равенстве (4.7) неизвестной величиной является R(t) — глубина проникновения ионов в среду 2. Для ее определения представим выражение (4.4) в приближенной форме [7], которая хорошо аппроксимирует истинное поле концентрации:
С2(х,0 = C0D(-x/Rf, (4.8)
где R — приближенное значение глубины проникновения ионов в среду 2.
Учитывая, что для полуограниченного тела при />0, CoD = const, и используя вариационный метод, получаем
R — l/U,3 D2t. (4.9)
Приближенное значение утечки массы в среду 2 получим из выражений (4.5), (4.8) и (4.9) в виде
т = 4SC0D2Dt/ уП 1,3D2t. (4.10)
Сопоставляя выражения (4.6) и (4.10), точное значение R записываем в виде
R= V4nD2t. (4.11)
Полагая Dz — Do (роль эталонной среды выполняла дистиллированная вода), из равенств (4.6) и (4.7) получаем выражение для коэффициента диффузии ионов дисперсного тела
£>, = kDo, (4.12)
где А = £ji-^-/(l—J2; Do — молекулярный коэффициент диффузии ионов.
|
|
|
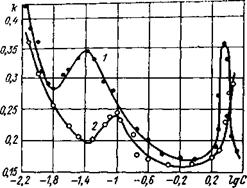
Рис. 4.1. Зависимость коэффициента k (кварц фракции 0,1—0,16 мм) от концентрации водного раствора. I — КС1, 2— СаС12. |
Эксперименты проводили с кварцевым песком, который кипятили в концентрированной азотной кислоте, а затем отмывали до нейтральной реакции в дистиллированной воде и высушивали при 105°С. Затем навески кварцевого песка засыпали слоем 2 см в стеклянные стаканы цилиндрической формы, которые помещали в эксикатор и в течение 1 ч вакууми- ровали с разрежением 0,5 • 104 Па. Далее, не снимая вакуума, поровое пространство заполняли водным раствором CaCU или КС1. Подготовленная таким образом испытуемая среда проходила термостатирование при 25°С до установления равновесного состояния. Затем отбирались излишки раствора вровень с поверхностью испытуемой среды. После этого сверху осторожно доливалась дистиллированная вода с той же температурой 25°С, т. е. процесс диффузии начинался и протекал в течение 72 мин при постоянной температуре. Продолжительность опыта 72 мин выбрана из тех соображений, чтобы объем воды был достаточен для определения концентрации ионов.
По истечении 72 мин эталонную среду осторожно отбирали пипеткой вровень с поверхностью кварцевого песка (захват раствора из порового пространства среды 1 исключался) и определяли ДС. Толщину слоя эталонной среды 2, отбираемой для анализа, находим из формулы (4.11). Молекулярный коэффициент диффузии ионов водного раствора КС1 и СаСЬ принимаем по данным работы [49]. Концентрацию ионов С1_ определяли титратором Т-201, ионов К+ — методом пламенной фотометрии, а ионов Са2+ — объемным титрованием. Оценочные эксперименты показали, что при определении концентрации по ионам К+ или С1~, а также Са2+ или С1_ различий не наблюдается. Поэтому в дальнейшем все определения проводили по иону С1- с 5—б-кратной повторяемостью.
Экспериментальные данные на рис. 4.1 и 4.2 показывают, что зависимость коэффициента k от концентрации электролита имеет своеобразный
характер. Для объяснения закономерности изменения представим k в виде
‘ »
* = (*i+fe2)e,, (4.13)
где k и ^2 — коэффициенты, учитывающие извилистость порового пространства и электрические свойства дисперсного тела; ei — объемная пористость.
|
|
|
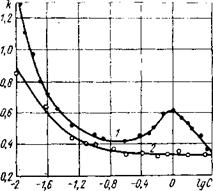
Рис. 4.2. Зависимость коэффициента k (кварц фракции 1—2 мм) от концентрации водного раствора. /-КС!; 2 — СаС1г. |
Однозначной характеристикой электрических свойств дисперсной фазы является основной параметр двойного электрического слоя (ДЭС) — электрокинетический потенциал, который при рН=2 окружающего кварц раствора становится равным нулю, т. е. система переходит в изоэлектри — ческое состояние (ИЗС) [Чураев Н. В., 1984 г.]. В этом случае ki = О и равенство (4.13) принимает форму
k = kle>. (4.14)
Определение k в ИЗС было выполнено при заполнении порового пространства кварца водным раствором НС1 концентрации 0,1 М с pH=2. Полученные значения k равны 0,32 и 0,17 соответственно для крупно — и мелкозернистого кварца при е* = 0,4. Если бы поровые каналы имели прямолинейную форму и не сообщались между собой, то ki = 1 и согласно формуле (4.14) k = 0,4. В действительности ft<0,4, т. е. /ei<l. Используя полученные в ИЗС значения k, составляющие 0,32 и 0,17, имеем k соответственно 0,8 и 0,43, т. е. извилистость (длина пути диффундирующих ионов) порового пространства мелкого песка выше, чем крупного. Отклонение величины k от k& — const определяет влияние электрического взаимодействия ионов с дисперсной фазой.
На рис. 4.1 и 4.2 показано, что при умеренных концентрациях электролита в заполняющей поровое пространство жидкости отмечается тенденция к снижению k с ростом С. Отрицательный потенциал поверхности кварца, создаваемый ионами ОН-, компенсируется избыточным потенциалом ионов К+ или Са2+, находящихся в диффузной части двойного электрического слоя. Это приводит к уменьшению ki в формуле (4.13), а значит, и k. Полученный результат соответствует данным работы [Чураев Н. В., 1984 г.], где резкий спад потенциала поверхности кварца фракции 100— 250 мкм отмечается при С>0,01 М^т. е. в области исследованных нами концентраций.
Кварц (рис. 4.3) имел следующий фракционный состав, %: более 1 мм — 0,02; от 1 до 0,63 — 1,92; от 0,63 до 0,4 — 18,63; от 0,4 до 0,315 — 25,4; от 0,315 до 0,25 — 25,78; от 0,25 до 0,2—15,86; от 0,2 до 0,16 — 5,94;
|
|
|
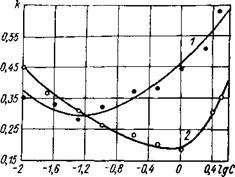
Рис. 4.3. Зависимость коэффициента k поли- фракционных тел от концентрации водного раствора КС1. / — портландцемент; 2 — кварц. |
от 0,16 до 0,1—3,81; менее 0,1 — 0,06. Фракционный состав портландцемента определить не представляется возможным, так как в контакте с водой происходит диспергирование цементных частиц. Однако очевидно, что он также является полифракционным. Характер поведения кривых отличается от данных на рис. 4.1 и 4.2 наличием одной экстремальной точки. Закономерность изменения k портландцемента соответствует опытам с кварцем, однако экстремальная точка смещена в область более низких концентраций. Такое отличие можно объяснить тем, что заряд поверхности гидратированного портландцемента имеет скорее всего положительный знак [8]. Подавление электрокинетического потенциала, видимо, происходит под влиянием ионов С1_, которые специфически адсорбируются на частицах цемента [8], т. е. компенсация потенциала поверхности происходит быстрее. Более высокое минимальное k объясняется пористостью 0,53 против 0,4 у кварцевого песка. Минимальное значение k кварца соответствует данным рис. 4.1.
В целом результаты рис. 4.1—4.3 имеют сложный немонотонный характер. В настоящее время нет общепринятой трактовки электрокинетических явлений в концентрированных растворах электролитов. Рядом авторов показана вероятность увеличения потенциала частиц, что объясняется различной растворяющей способностью сольватного слоя относительно катионов и анионов. Другим объяснением, которое также рассматривалось в литературе при анализе экспериментальных данных, могут быть положения теории сильных электролитов [76]. Согласно этой теории в концентрированных растворах формируются ближний порядок распределения ионов и осциллирующий потенциал вокруг иона. Высказано предположение, что в концентрированных растворах и вокруг заряженной частицы потенциал будет осциллировать, т. е. зависимость k от концентрации электролита будет иметь немонотонный характер. Интересно отметить, что экстремальные точки на рис. 4.1 в случае заполнения порового объема кварцевого песка раствором СаСЬ смещены в область более высоких концентраций. Возможно поэтому отсутствует экстремум на нижней кривой рис. 4.2.
В зависимости от концентрации и состава порового раствора коэффициент диффузии может изменяться в широких пределах. Так, на рис. 4.2 h сначала изменяется от 1,3 до 0,4, т. е. коэффициент диффузии уменьшается в 3,25 раза. В дальнейшем k возрастает в 1,5 раза и вновь падает до значения около 0,32, что соответствует полученному в изоэлектриче — ском состоянии. В целом k изменяется от 1,3 до 0,32, т. е. снижается в 4,3 раза. При заполнении порового пространства кварцевого песка раствором хлористого кальция k монотонно стремится к тому же значению 0,32.
Для мелкозернистого кварца получено два максимума. При этом повторное возрастание k более значительно, чем в случае крупнозернистого кварца: в 2 раза. Коэффициент диффузии в диапазоне исследованных концентраций уменьшается в 2,5 раза.
Таким образом, минимальное значение коэффициента диффузии лимитируется только извилистостью порового пространства дисперсного тела. При малых концентрациях электролита диффузию в основном определяет коэффициент /гг, т. е. силы электрического взаимодействия ионов с поверхностью твердой фазы. В области высоких концентраций коэффициенты k и ki имеют один порядок.