СПЕЦИАЛЬНЫЕ МЕТОДЫ ОБРАБОТКИ ВОДЫ ДЛЯ ТЕХНИЧЕСКОГО ВОДОСНАБЖЕНИЯ
СПЕЦИАЛЬНЫЕ МЕТОДЫ ОБРАБОТКИ ВОДЫ ДЛЯ ТЕХНИЧЕСКОГО ВОДОСНАБЖЕНИЯ
Обезжелезивание воды. В поверхностных водах железо обычно встречается в виде органических и минеральных комплексных соединений либо коллоидных или тонкодисперсных взвесей. Преобладающей формой существования железа в подземных водах является бикарбонат железа (ІҐ), который устойчив только при наличии значительных количеств углекислоты и при отсут — ствии растворенного кислорода. Наряду с этим железо встречается в виде сульфида, карбоната и сульфата железа (II), комплексных соединений с гуммата- ми и фульвокислотама 2+
При pH < 4,5 железо находится в воде в виде ионов Fe3+; Fe2+ и Fe (ОН) ■ Повышение значения pH приводит к окислению железа (II) в железо (ID).If0′ торое выпадает в осадок. В этих условиях прн Eh < 0,2 В и наличии в воде сульфидов может выделяться черный осадок FeS. В восстановительной среде в присутствии карбонатов и при pH > 8,4 возможно выделение карбоната, Я при pH > 10,3 — гидроксида железа (II).
Окисные соединения железа, находящиеся в виде коллоидно — и тонкодис — перснЫХ взвесей, хорошо удаляются при обычной коагуляции примесей. Поэтому обезжелезивание поверхностных вод производят одновременно с их осветлением и обесцвечиванием коагулянтами. В тех случаях, когда в воде открытых источников водоснабжения содержится железо (II), проводят аэрирование воды или хлорирование повышенными дозами. Для обезжелезивания подземных вод применяют аэрирование, обработку воды перманганатом или хлором в сочетании с аэрированием или без него. После осуществления каждого из этих процессов, обеспечивающих окисление соединений железа (II) с выделением водного оксида железа (III), предусматривается фильтрование воды. Железо удаляют из воды катионированием, если одновременно необходимо ее умягчение. При этом полностью исключают контакт обрабатываемой воды с воздухом для предупреждения окисления ионов железа (II). Возможно также обезжелезивание воды при фильтровании ее через слой пиролюзита, «черного песка, или песка, покрытого оксидами железа, являющимися катализаторами окисления железа (II).
Хлорирование воды обусловливает переход соединений железа (II) в соединения железа (III), которые в присутствии гидрокарбонатов природных вод полностью гидролизуются по реакции
2Fe24 + С12 + 6НС03 = 2Fe(OH)3 і + 2СГ + 6С02 Т. (3.53)
На окисление I мг железа (II) расходуется 0,64 мг хлора, щелочность воды
при этом снижается на 0,054 мг-экв/дм3. Дозу хлора Д^, мг/дм3. рассчитывают по формуле
Л,, =0,7(Fe2+), (3.54)
где (Fe2+) — содержание железа (II) в исходной воде, мг/дм3.
При обработке воды перманганатом калия реакция окисления и последующего гидролиза протекает по уравнению
4Fe2’1′ + Мп04” + 8НС03~ + 2Н20 = 4Fe(OH)3 4 + Mn02i + 8С021. (3.55)
На окисление 1 мг железа (И) расходуется 0,71 мг перманганата калия, и щелочность воды, уменьшается при этом на 0,036 мг — экв/дм3, дозу перманганата калия Да мг/дм предусматривающую некоторый его избыток, определяют по формуле
Л — =<Fe2+). (3.56)
Окисление железа (II) кислородом воздуха, наблюдаемое при аэрировании воды, происходит по реакции
4Fe2+ + 02 + 8HCO3 + 2H20 = 4Fe(OH)3^ +8C02t. (3.57)
На окисление 1 мг железа (II) расходуется 0,143 мг кислорода. Процесс замедляется при наличии в растворе углекислоты, заметно понижающей pH воды, поэтому для быстрого завершения окисления и гидролиза необходимо удалять ее аэрированием или связывать известью.
Повышение pH воды благоприятствует протеканию процесса обезжелезивания pH воды в заданных границах поддерживают, добавляя в нее известь или соду.
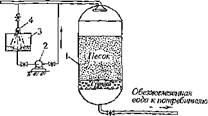
Схема установки для обезжелезивания подземных вод упрощенной аэрацией с введением воздуха центробежным или вихревым насосом показана иа рис. 3.37.
При засасывании насосом исходной воды из бачка, в который она поступает через душевую насадку, образуется водовоздушная эмульсия. Количество воздуха, подаваемого насосом, должно составлять около 2 м3 иа каждый килограмм удаляемого из воды железа (II).
Избыток растворенного кислорода при насыщении воды воздухом с целью ее обезжелезивания не должен превышать 0,6 мг/дм3 02 на 1 мг Fe2 ’ с тем, что бы часть жатеза окислялась в толще фильтрующей загрузки.
|
|
|
Вода из скважины |
|
"°й аэради: ‘гнаюрный фи е —— насос; 3 — бачок; 4 — душеная на- |
|
Рис. 3.37, Схема установки для обезжелезивания подземных вод упрошен- |
Деманганация воды. Для удаления из воды марганца используют те же методы, что и при обезжелезивании воды. Обычно соединения марганца выделяют из воды, одновременно с соединениями железа. Деманганация воды может быть достигнута аэрированием, иногда совмещенным с известкованием воды, обработкой воды сильными окислителями — хлором, озоном и др., коагуляцией прнмесей воды сульфатом железа(ІІІ), фильтрованием воды через Na — катионит либо пропусканием воды через катиоиитовые фильтры с марганцевым катализатором. Во всех этих методах обработки воды, кроме катиониро — вания, предусматривается фильтрование ее на напорных или самотечных фильтрах.
При аэрировании воды ионы марганца (И) окисляются, в ионы марганца (III) и (IV), которые, гидролизуясь, выделяются в осадок в виде гидроксидов. Для обеспечения полноты удаления марганца воду необходимо подщелачивать до pH > 9,5+10,0 или фильтровать ее через контактный фильтр, загруженный дробленым пиролюзитом или «черным песком».
Хлором ионы марганца (II) окисляются достаточно быстро только при pH > 4. При наличии в воде аммиака и аммонийных солей доза хлора должна обеспечивать окисление хлораминов и марганца. Для полного разрушения хлорами — нов необходимо вводить около б мг хлора на 1 мг содержащегося в воде аммиака и, кроме того, 1,3 мг хлора на окисление 1 мг Мп2+ в Мп3′.
Диоксид хлора и озон окисляют ионы марганца (II) при pH воды 6,5-7,0 в течение 10-15 мин: расход диоксида хлора составляет 1,35 мг, шона—1,45 мг на 1 мг Мп2*.
Наиболее полно удаляются ионы марганца при озонировании воды; образующийся под действием этого сильного окислителя нерастворимый водный оксид марганца (IV) выделяется из воды при филировании ее через зернистые загрузки скорых фильтров.
Из поверхностных вод марганец может быть удален коагулированием сульфатом железа (II) FeS04 с подщелачиванием воды до pH 9,5-10,5. При этом значительная часть выделяющихся гидроксидов железа и марганца задерживается обычно в отстойниках или осветлителях со взвешенным осадком, а остальная часть — на скорых осветлительных фильтрах.
Ионы марганца (II) могут быть удалены из воды на Na-катионитовых фильтрах. Как и в случае обсзжелезивания воды, установка должна быть хорошо герметизирована для предупреждения попадания кислорода воздуха и образования при этом гидроксидов, загрязняющих катионит.
Марганец удаляют из воды также биохимическим методом, пропуская ее через напорные фильтры с грубозернистым песком (d = 3 мм) со слоем высотой 1,5 м, засеянным небольшим количеством маргаиецпотребляющих бактерий, со скоростью до 30 м/ч. Отмирающие бактерии образуют на поверхности зерен песка биомассу, содержащую оксиды марганца, катализирующие окисление.