УДАЛЕНИЕ ИЗ ВОДЫ РАСТВОРЕННЫХ ГАЗОВ (ДЕГАЗАЦИЯ ВОДЫ)
УДАЛЕНИЕ ИЗ ВОДЫ РАСТВОРЕННЫХ ГАЗОВ (ДЕГАЗАЦИЯ ВОДЫ)
Во многих случаях низкое качество продукции и износ оборудования связаны с наличием газов в воде, используемой в технологическом процессе (например, в теплоэнергетике, в водоснабжении горячей водой и т. д.).
Чаще всего приходится удалять из воды С02,02 и H2S. Эти газы относятся к агрессивным, они обусловливают либо усиливают коррозию металлов. Кроме того, СО, агрессивен по отношению к бетону и отрицательно влияет на эффективность работы анионитовых фильтров.
При про пускании обрабатываемой воды через Н-катионитовый фильтр вследствие разложения гидрокарбонатов в воде может образоваться большое количество свободного С02. Между тем даже незначительное содержание его в умягченной воде, которая подается для питания паровых котлов, вызывает коррозию труб и оборудования. Удалять из воды свободный С02 приходится и при обезжелезивании воды. Довольно часто необходимо удалять из воды растворенный в ней 02.
Указанные свойства этих газов, а также способность H2S придавать воде неприятный запах обусловливают необходимость возможно более полного удаления их из воды.
Комплекс мероприятий, связанных с удалением из воды растворенных в ней газов, называется дегазацией воды. Существуют физические и химические, методы дегазации воды.
Химические методы основаны на применении реагентов, связывающих растворенные в воде газы. Например, обескислороживание воды может быть Достигнуто путем введения в нее сульфита натрия, сернистого газа или гидра — зингидрата. Сульфит натрия при введении его в воду окисляется растворенным в воде кислородом до сульфата натрия
2Na2 S03 +02 -* 2Na2S04. (3.58)
При применении сернистого газа образуется сернистая кислота
S02+H20->H2S03+02 + H2S04, (3.59)
которая кислородом, растворенным в воде, окисляется до серной кислоты.
Реагентом, с помощью которого удается достичь практически полного обескислороживания воды, является гидразингидрат. При этом происходит связы — вание кислорода и выделение инертного азота
N2H4+02 -»2H20 + N21 (3.60)
Этот химический способ обескислороживания воды является наиболее совершенным, но вместе с тем и наиболее дорогим, поэтому он применяется в основном для целей дообескислороживаяня воды после физических методов ее дегазации.
К химическим методам относится получивший довольно широкое распространение метод обескислороживания воды с помощью сталестружечных фильтров. Обрабатываемая вода фильтруется через слой стальных стружек, при этом кислород связывается по следующей реакции:
3Fe + 202 ->Fe304. (3.61)
Продолжительность контакта стружек и воды, требуемая для обескислороживания, составляет 1,5-2 мин. Стружки приходится заменять через 6-12 мес. на 1 кг задерживаемого кислорода необходимо 5 кг стружек. Учитывая, что насыпная масса стружек при их уплотнении близка к 1 т/м, необходимый объем их, в м3, можно определить по формуле
F = 5-10-(QCl (3.62)
где Q — средний расход, обескислороживаемой воды, м3/ч; С— концентрация кислорода в воде, г/м3; t — время работы фильтра за период между сменами стружек, ч.
Площадь поперечного сечения фильтра определяют по скорости фильтрования 25-100 м/ч так, чтобы при найденной высоте слоя стружек обеспечивалась продолжительность контакта воды с ними не менее 1,5 мин.
Связывание свободной углекислоты может быть достигнуто добавлением в воду извести или едкого натра; при этом свободная углекислота переходит последовательно в бикарбонат-ион и карбонат-ион.
Примером химического метода удаления из воды сероводорода может служить обработка воды хлором
2H2S+5С12 + 4Н20 -> S + H2SO„ + 10HCI. (3-63)
Для этой же цели можно рекомендовать озонирование воды.
Недостатки химических методов дегазации воды: применение реагентов, усложняющих и удорожающих процесс обработки воды; ухудшение качества воды при нарушении дозировки реагентов.
Сущность физических методов удаления из воды растворенных газов заключается в следующем: дегазируемая вода приводится в соприкосновение с воздухом, если парциальное давление удаляемого газа в воздухе близко к нулю; обеспечивают условия, при которых растворимость газа в воде становится близкой к нулю.
С помощью первого метода, т. е. аэрации воды, обычно удаляют свободную углекислоту, метан и сероводород, поскольку парциальное давление этих газов в атмосферном воздухе близко к нулю. Второй метод используют при обескислороживании воды, так как при значительном парциальном давлении кислорода и атмосферном воздухе аэрацией воды кислород из нее удалить нельзя. Для удаления кислорода из воды ее доводят до кипения, при котором растворимость всех газов в воде падает до нуля. Вода доводится до кипения либо с помощью ее нагрева (термическое деаэрирование), либо с помощью понижения давления (вакуумирование).
Дегазацию воды в процессе водоподготовки осуществляют на дегазаторах различных типов.
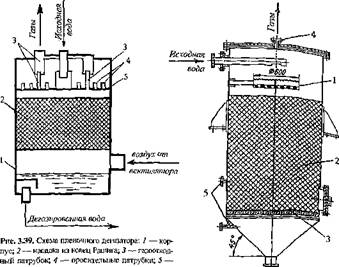
Пленочные дегазаторы (рис. 3.39) представляют, собой колонны, загруженные насадкой (деревянными, керамическими или пластмассовыми кольцами и др.), по которой вода стекает тонкой пленкой. Насадка служит для создания развитой поверхности контакта воды и воздуха, нагнетаемого вентилятором навстречу потоку’ воды.
Барботажные дегазаторы — это аппараты, в которых через пленочный слой медленно движущейся дегазируемой воды продувается сжатый воздух. Из-за сравнительно большого расхода электроэнергии на компрессию воздуха используются редко.
Вакуумные дегазаторы (рис. 3.40) представляют собой аппараты, в которых с помощью специальных устройств (вакуум-насосов, паро — или водоструйных эжекторов) создастся пониженное давление, при котором вода кипит при данной температуре, чем обеспечивается ее дегазация.
При водоподготовке обычно применяют пленочные дегазаторы и для обескислороживания воды — вакуумные или термические. При проектировании пленочных дегазаторов определяют площадь поперечного сечения аппарата, расход воздуха, площадь поверхности насадки и необходимый напор, развиваемый вентилятором.
Для глубокого удаления из воды свободной углекислоты (до 3-5 мг/дм3) следует применять дегазаторы с насадкой из пластмассовых колец или из колец Рашига (керамических), либо вакуумно-эжкционные аппараты.
Умягчение воды диализом. Диализ — метод разделения растворенных веществ, значительно отличающихся молекулярными массами. Он основан на разных скоростях диффузии этих веществ через полупроницаемую мембрану, разделяющую концентрированный и разбавленный растворы. Под действием градиента концентрации (по закону действующих масс) растворенные вещества с различными скоростями диффундируют через мембрану в сторону’ разбавленного раствора. Растворитель (вода) диффундирует в обратном направлении, снижая скорость переноса растворенных веществ. Диализ осуще-
|
распределительная плита і Дегазированная]. Рис. 3.40. Схема вакуумного дегазатора: 1 — водораспределительная во^а I тарелка; 2 — насадка из колец Рашига; 3 — дырчатое днище; 4 — патрубок для отсоса газов; 5 — места установки водомерных стекол |
ствляют в мембранных аппаратах с нитро- и ацегатцеллюлозными пленочными мембранами.
Эффективность полупроницаемой мембраны для умягчения воды определяется высокими значениями селективности и водопроницаемости, которые она должна сохранять в течение продолжительного времени работы.
Для получения воды для хозяйственно-питьевых нужд обычно умягчалась лишь ее некоторую часть с последующим смешиванием с исходной водой, при этом количество умягчаемой воды определяют по формуле
еу= Ю0[(Жо1 ,-^,)/(ЖШ1-Жу)], (3.64)
где Жа„,жм иЖу — общая жесткость, мг-экв/дм3 исходной воды, воды, поступающей в сеть, и умягченной воды.
Термический метод умягчения воды целесообразно применять при использовании карбонатных вод для питания котлов низкого давления, а также в сочетании с реагентными методами умягчения воды. Он основан на смещении углекислотного равновесия при ее нагревании в сторону образования карбоната кальция. Равновесие смещается за счет понижения растворимости оксида углерода (IV), вызываемого повышением температуры и давления. Кипячением можно полностью удалить оксид углерода (IV), и тем самым значительно снизить карбонатную кальциевую жесткость. Однако полностью устранить указанную жесткость не удается, поскольку карбонат кальция хотя и незначительно (13 мг/дм3 при температуре 18 °С), но все же растворим в воде.
При наличии в воде і-идрокарбонага магния процесс его осаждения происходит следующим образом: вначале образуется сравнительно хорошо растворимый (110 мг/дм3 при температуре 18 °С) карбонат магния, который при продолжительном кипячении гидролизуется, в результате чего выпадает осадок малорастворимого (8,4 мг/дм3) гидроксида магния. Следовательно, при кипячении воды жесткость, обусловливаемая гидрокарбонатами кальция и магния, снижается. При кипячении воды снижается также жесткость, определяемая сульфатом кальция, растворимость которого падает до 0,65 г/дм’.
Известковый метод используют для частичного устранения из воды карбонатной жесткости (т. е. для снижения щелочности воды). Самостоятельного распространения он не получил; обычно его сочетают с содовым или катионито — вым методом. Введение в воду гашеной извести в виде известкового молока или раствора в первую очередь вызывает нейтрализацию свободной углекислоты, растворенной вводе, с образованием малорастворимого декантирующего карбоната кальция
Са(ОН)2 +С02 = СаС031+Н20 . (3.65)
Добавление извести в количестве, большем, чем необходимо для нейтрали — зации свободной углекислоты, вызывает распад бикарбонатов, в результате которого из воды выделяется карбонат кальция:
Са(НС03)2 + Са(ОН)2 = 2СаС024 +2Н20. (3.66)
Дальнейшее введение в воду извести приводит к гидролизу магниевых солей и образованию малорастворимого гидроксида магния Mg(OH),, который при pH > 10,2-10,3 выпадает в осадок:
-^^^ + Са(0Н)2=-!^^ + СаС034^^^. (3.67)
MgC03 2 Mg(OH)2 і 1
Известкованием устраняют из воды и некарбонатную магниевую жесткость при условии, что pH воды будет ниже 10,2:
|
Таблица 3.27 ХАРАКТЕРИСТИКА МЕТОДОВ УМЯГЧЕНИЯ ВОДЫ
|
^ГгГ+ Са(ОН)2 — Mg(OH)2 4 +^i (3.68)
JVl^v^* 17 (_аСІ2
Приведенные уравнения показьшают, что магниевая жесткость устраняется, по значение общей жесткости остается неизменным, так как магниевая жесткость заменяется кальциевой, некарбонатной. Следовательно, известкованием воды может быть в той или иной мере (в зависимости от условия реакции) устранена карбонатная и магниевая жесткость воды, но не может быть снижена некарбонатная жесткость.
Известково-содовый метод умягчения воды применяют для устранения карбонатной и некарбонатной жесткости, вводя в воду известь и соду. Химизм процесса описывается реакцией
После добавления в воду щелочных реагентов происходит мгновенное образование коллоидных соединений СаС03, и Mg (0Н)2, однако их переход от коллоидного состояния в грубодисперсное, т. е. в то состояние, при котором они выпадают в осадок, занимает длительное время, измеряемое часами.
Снижение щелочности воды при известковании зависит главным образом от ее температуры при соблюдении оптимальных доз реагентов. Так, при известковании воды без подогрева остаточная щелочность ее составляет не менее 0,7 мг-экв/дм3, а при подогреве до 80-90 °С можно достичь снижения щелочности до 0,2-0,3 мг-экв/дм Глубина умягчения воды при известково-содовом методе соответственно равна: без подогрева воды 1-2 мг-экв/дм3, при подогреве воды до 80-90 °С 0,2—0,4 мг-экв/дм3
Едконатровый метод умягчения воды описывается следующими химическими реакциями:
<^HCS,1>2 т 2КаОН — + Na2C03 + Н20 + —Ц-; (3.70)
Mg(HC03)2 Mg(OH)24 СОЛ
■^^i+Na2C03=^^^- + CaC03J.; (3.71)
CaCI2 2 2NaCi
C02 + NaOH = Na2C03 + H20 ; (3.72)
TTT?±+2NaOH=I^i+Mg(OH)24- (3’73)
MgCI2 2NaCl
Из приведенных реакций следует, что едкий натр в процессе умягчения воды расходуется на устранение карбонатной и магнезиальной жесткости и нейтрализацию свободной углекислоты, а сода, образующаяся при распаде бикарбонатов и нейтрализации угаекислоты, используется на удаление кальциевой некарбонатной жесткости. Следовательно, едконатровое умягчение воды целесообразно применять при наличии такого соотношения между карбонатной жесткостью, содержанием свободной углекислоты и кальциевой некарбонатной жесткостью, когда образующейся соды при распаде бикарбонатов и взаимодействии со свободной углекислотой достаточно для удаления кшіьциевой некарбонатной жесткости, т. е. справедливо равенство
ЖСв+Щ = 2Ж1С+[С02], (3.74)
щеЖСа — кальциевая некарбонатная жесткость исходной воды, мг-экв/дм3; Щ — елочность умягченной воды, мг-экв/дм3; Жк — карбонатная жесткость исходной воды, мг-экв/дм3; 2Жк — количество соды, образующейся при взаимодействии едкого натра с карбонатной жесткостью, мг-экв/дм3; С02 — содержание свободной углекислоты в исходной воде, мг-экв/дм3.
При нарушении равенства едконатровый метод умягчения воды применять нельзя. При условии (2Ж. + С02) > (ЖС; + С02) в обрабатываемую воду необходимо вводить известь, а при (2Жк + С02) < (ЖС!1 + Щ) — соду.
Глубина умягчения воды при едконатровом методе такая же, как и при известково-содовом, т. е. остаточная жесткость практически около 1 мг-экв/дм, а при подогреве умягченной воды — 0,2-0,4 мг-экв/дм3.
Фосфатный метод умягчения воды при использовании тринатрийфосфата является наиболее эффективным реагентным методом. Химизм процесса умягчения воды тринатрийфосфатом описывается реакциями:
(3.75)
3Mg(Hco3)2 Mg3(po4)24-
—g^l + 2Na2PQ4 jNajSO^. (3.76)
3MgCI2 Mg3(P04)2sl 6NaCI ‘
Как видно из приведенных реакций сущность метода заключается в образовании кальциевых и магниевых солей фосфорной кислоты, которые обладают малой растворимостью в воде и поэтому достаточно полно выпадают в осадок.
Фосфатное умягчение обычно осуществляют при подогреве воды до 105— 150 °С, достигая ее умягчения до 0,02-0,03 мг-экв/дм3. Из-за высокой стоимости тринатрийфосфата фосфатный метод обычно используют для доумягче — ния воды, предварительно умягченной известью и содой.
Катионитовый метод умягчения воды основан на способности некоторых практически нерастворимых в воде веществ, называемых катионитами, обменивать содержащиеся в них активные группы катионов (натрия, водорода и др.), на катионы кальция или магния воды, определяющие ее жесткость. Умягчаемую воду фильтруют через слой катионита, при этом катионы кальция и магния из воды переходят в катиони ты, а в воду переходят катионы натрия или водорода. Катионитовый метод позволяет достичь глубокого умягчения воды (0,01-0,02) мг-экв/дм3. Обменная способность катионита постепенно истощается. Ее можно восстановить, пропуская через катионит раствор поваренной соли, серной или соляной кислоты. В зависимости от того, каким реагентом отрегенерирован катионит, рачличают Na-катионит (обменный катион натрия при регенерации поваренной солью) или Н-катионит (обменный катион водорода при регенерации кислотой).
Химизм процесса Ка-катионирования описывается реакциями:
2NA[K] + Ca(HCCVb 0 Са[К]^ + ЖаПС0 (3.77)
Mg(HC03)2 Mg[KJ2
2Na[K]+—^ о + 2NaCl; (3.78)
MgCl Mg[K]
2Na[K]+-^2l-»-^^- + Na2S04; (3.79)
MgS04 Mg[K]2
2Na[K] + -^|^f-O^^ + Na2Si03. (3.80)
MgSiOj Mg[K]2
В приведенных реакциях символом [К] обозначен комплекс катионита, практически нерастворимый в воде. Из этих реакций видно* что жесткость профильтрованной через катионит воды устраняется, а щелочность ее остается эквивалентной карбонатной жесткости умягчаемой воды. Поэтому чем больше карбонатная жесткость умягчаемой воды, тем выше и щелочность умягченной.
Процесс Н-катионирования описывается реакциями:
2НГК1 + -^^^г-<»-^^2- + 2Н20 + с02Т; (3.81)
iHLKJ Mg(HC03)2 Mg[K]2
MgCl Mg[K]2
|
|
(3.83)
|
|
|
2Н[К] |
(3.84)
|
(3.85) (3.86) |
2Н[К] + Na2S04 <=> 2Na[K] + H2S04; Н[К]+NaCl о Na[K] + HCI.
Приведенные реакции показывают, что в результате Н-катионирования в умягченной воде образуются минеральные кислоты в количестве эквивалентном содержанию сульфатов и хлоридов в исходной воде, а также свободная углекислота (за счет карбонатной жесткости исходной воды).
Таким образом, после натрий-катионирования получается щелочной фильтрат, а после водород-катионирования кислый. Смешивая оба фильтрата в определенной пропорции, можно получить практически полностью умягченную воду с заданной величиной ее щелочности. В этом состоит сущность умягчения воды по схеме Н-Ка-катионирования.
Каждый катионит обладает определенной обменной способностью, которая выражает то количество катионов, которое может задержать (обменять) катионит в течение фильтроцикла. В практике водоподготовки обменную способность катионита выражают в грамм-эквивалентах задержанных катионов на I м3 катионита, находящегося в разбухшем состоянии после пребывания в воде, т. е. в рабочем состоянии. Различают полную и рабочую обменные способности катионита.
Полной обменной способностью называется то количество грамм-эквива — лентов кальция и магния, которое может задержать 1 м3 катионита, находящегося в рабочем состоянии, до того момента, когда жесткость фильтрата сравняется с жесткостью исходной воды. Рабочей обменной способностью катионита называется количество грамм-эквивалентов катионов кальция и магния, которое задерживается 1 м3 катионита до момента проскока в фильтрат некоторой жесткости, превышающей норму Отношение обменной способности ко всему объему катионита, загруженного в фильтр, называют емкостью поглощения и выражают так же, как и обменную способность, в г-экв/м.
Фильтроцикл на катионитовом фильтре продолжают до момента проскока фильтрат жесткости. Тогда фильтр отключают на регенерацию. РегенераЦ,)Я катионитового фильтра состоит из трех последовательных операций: шрых ления, собственно регенерации и отмывки катионита.
Взрыхление катионита производится током воды снизу вверх аналогич промывке песка в осветлительных фильтрах. Эта операция ликвидирует сЦре
сованность катионита, которая получается при фильтровании под давлением и которая может привести к неравномерному прохождению регенерирующего pactbopa через толіцу катионита и, следовательно, к неполной его регенерации. При взрыхлении удаляются измельченные частицы катионита, что предотвращает заклинивание щелей дренажа; а также частицы взвеси, осевшие на иоиообменнике и снижающие его активность.
Собственно регенерация заключается в фильтровании регенерирующего раствора через слой катионит а. При регенерации Na — или Н-катионита ионы Na1 или ЬҐ, содержащиеся в регенерирующем растворе, вытесняют из катионита катионы (Са2 , Mg2), задержанные при рабочем цикле фильтрования, которые переходят в раствор. Катионит же, вновь обогащенный обменными катионами Na+ или Н1, восстанавливает свою обменную способность. Химизм регенерации катионита описывается реакциями:
Са[К]2 +2NaCl<^2Na[K]+—-2-; (3 87)
Mg[K]2 MgCl
Са[К]2 ог< ^ тигі^і і CaS04
+ H, S04o2H[K]+—. (3.88)
Mg[K]2 MgS04
Заключительная операция регенерации катионита состоит в отмывке его от избытка регенерирующего раствора и продуктов регенерации (соединений кальция и магния, вытесняемых из катионита). Отмывку производят обычно током воды сверху вниз. После отмывки катионита фильтр вновь включают в работу.
Выбор схемы катионитового умягчения воды зависит главным образом от тех требований, которые предъявляют к умягченной воде, а также от качества исходной воды. Наиболее простой является установка, состоящая из одной ступени Ка-катионитовых фильтров. Сущность работы такой установки заключается в однократном (одноступенчатом) фильтровании воды через Na-катионит. Количество фильтров в установке принимают не менее двух, чтобы не прерывать полезной работы установки во время регенерации. Большим преимуществом такой схемы по сравнению с Н-катионитовыми фильтрами явля — еіся то, что отсутствуют вода и растворы с кислой реакцией и, следовательно, нет необходимости в применении кислотостойкой арматуры, труб и защитных покрытий самих фильтров. Кроме того, от установки ие поступают в канализацию кислые стоки, требующие нейтрализации.
Применение такой схемы, можег быть рекомендовано в следующих случаях: 1) когда не лимитируется щелочность умягченной воды или когда предельно допускаемая щелочность ее не превышает карбонатной жесткости исходной воды; 2) при общей жесткости исходной воды не более 10 мг-экв/дм3 и при условии что жесткость фильтрата допускается 0,1-0,2 мг-экв/дм3.
Схеме одноступенчатого Na-катионирования свойственны и серьезные недостатки, которые в раде случаев ограничивают ее, применение: практическая, невозможность глубокого умягчения воды; относительно высокий удельный расход соли на регенерацию фильтров; неполное использование емкости поглощения фильтра.
Этих недостатков нет в схемах двухступенчатого Na-катионирования. При такой схеме фильтрование воды на фильтрах первой ступени производится не до проскока в фильтрат повышенной жесткости, а до тех пор, пока жесткость фильтрата не достигнет 25-30 % жесткости исходной воды. Следовательно, емкость поглощения фильтров 1-й ступени более высокая, чем при одноступенчатом умягчении, и приближаегся к полной. Ввиду того, что основная масса катионов жесткости задерживается в фильтре 1-й ступени, фильтры 2-й ступени несут незначительную нагрузку по жесткости и рабочий цикл на них обычно длится 150-200 ч. За весь этот период фильтры дают глубокоумягченпую воду (0,01-0,02 мг-экв/дм3).
При двухступенчатом Na-катионировапии удается снизить расход соли на регенерацию. Эта экономия достигается за счет снижения удельных расходов соли на регенерацию фильтров 1-й ступени 120-150 г на 1 г-экв поглощенных катионов (вместо 200-225, при одноступенчатом катионировании).
Фильтры 2-й ступени, наоборот, регенерируют с применением повышенных удельных расходов соли (300-400 г на1 г-экв поглощенных катионов), однако из-за того, что эти фильтры регенерируются сравнительно редко, общий расход соли уменьшается по сравнению с расходом ее на установках одноступенчатого Na-катионирования. Схема двухступенчатого Na-катионирования особенно целесообразна при умягчении вед высокой жесткости (8-10 мг-экв/дм )•
Описанные выше схемы Ка-катионирования становятся непригодными в тех случаях, когда карбонатная жесткость исходной воды превышает щелочность умягченной воды. В этих случаях необходимо принимать дополнительные меры по устранению щелочности воды или доведению ее до допустимых пределов.
Наиболее простым способом снижения щелочности воды, умягченной на Ка-катионитовых фильтрах, является подкислеиие ее серной или соляной кислотой с последующим удалением выделяющейся при нейтрализации щелочности свободной углекислоты. Такой прием можно применять в тех случаях, когда увеличение еолесодержания воды за счет ее подкисления не препятствует дальнейшему использованию этой воды. Чаще же снижение щелочности воды достигается применением H-Na-катионирования или смешанного способа умягчения — реагенгно-катионитового. В последнем случае карбонатная жесткость исходной воды перед ее последующим №-катионированием устраняется известкованием.
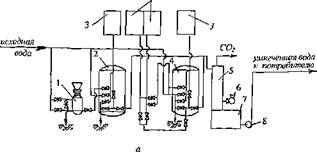
На рис. 3.41, а показана часто применяемая схема так называемого параллельного Н-№-катионирования. Оба фильтрата смешиваются в определенной пропорции и подаются в дегазатор для удаления из воды свободной углекислоты, которая образуется при распаде бикарбонатов в процессе Н-катиониро — вания и при смешивании Н — и 1Ча-катионированных вод. Для взрыхления используют обычно воду после отмывки катионита (за исключением первых ее порций, сбрасываемых в канализацию, так как они содержат большое количество катионов жесткости). Использование этой воды позволяет снижать расходы воды на нужды катионитовой установки.
При необходимости постоянного и глубокого умягчения воды (до 0,03 мг — экв/дм3) схему, приведенную на рис. 3.41, а приходится дополнять "Ыа-катони — товыми фильтрами 2-й ступени, так как при практически приемлемой системе контроля за работой катионитовых фильтров при одноступенчатом катиони — ровании трудно уловить начало проскока жесткости в фильтрат и, следовательно, предотвратить периодическое ухудшение ее качества. Большим преимуществом схем параллельного Н-№-катионирования является возможность снижения щелочности воды до 0,3-0,4 мг-экв/дм3, что обычно не достигается при иных схемах Н-Ка-катионирования. Такую схему умягчения воды рекомендуется применять, если концентрация сульфатов и хлоридов в исходной воде не превышает 4 мг-экв/дм3, а содержание натрия — — не более 2 мг-экв/дм3.
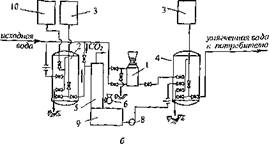
Другим часто применяемым приемом катионитового умягчения воды является так называемое последовательное H-Na катионирование (рис.3.41, б). Сущность его заключается в том, что часть общего потока умягчаемой воды пропускается через Н-катонитовые фильтры, затем смешивается с остальной частью умягчаемой воды с целью нейтрализации кислотности фильтрата и пропускается через дегазатор. Из промежуточного бака вода прокачивается насосами для доумягчения через Na-катионитовые фильтры. Если предъявляются повышенные требования к глубине умягчения и если жесткость исходной воды значительна (свыше 8 мг-экв/дм3), то после Na-квтионитовых фильтров вода прокачивается еще через Ка-катионитовые фильтры 2-й ступени.
При работе по схеме последовательного H-Na-катионирования можно более полно использовать емкоехъ поглощения Н-катионитового фильтра, так как при последующем пропуске всей умягчаемой воды через Ка-катнонитовые фильтры отключение Н-катионитовых фильтров на регенерацию производят Не по проскоку катионов Са2+ и Mg21 в фильтрат, а при Достижении определенной жесткости (~1 мг-экв/дм3). Остаточная щелочность умягченной воды, обработанной по такой схеме, составляет ~0,7 мг-экв/дм. Схему последовательного H-Na-катионирования рекомендуется применять при повышенных жесткости и солесодержании умягчаемой воды.
Простейшей схемой ЩМа-катионирования является совместное H-Na-кати — онирование которое осуществляется в одном и том же фильтре, одновременно снижая щелочность фильтрата (до 1—138 мг-экв/дм3) и достаточно глубоко его умягчая. Возможность такой работы фильтров обусловливается тем, что верхний слой катионита в фильтре подготовлен для работы по циклу Н-катиониро — вания, а нижний слой — по циклу Ка-катионитового умягчения. Преимуществом метода является отсутствие кислых сбросных вод, в связи, с чем не Требуется их нейтрализация, а недостатком—сравнительная сложность проведения регенерации.
|
|
|
Рис. 3.40. Схемы установок для параллельного и последовательного Н-№-катиоиирования: 1 со’ лерастворитель; 2 Н-катионитовыЙ фильтр; 3 — бак с водой для взрыхления загрузки фшплров* 4 — Ка-катионнтовый фильтр; 5 — дегазатор; 6 — вентилятор; 7 — сборный бак; 8 — насос; 9 ~ промежуточный бак; 10 — бак с кислотой |
Совместное Н-ЇЧа-катионирование может применяться* когда требования к умягченной воде не слишком высоки (жесткость до 0,1-0,3 мг-экв/дм3 Н 1Де"
лочность ис ниже 1 мг-экв/дм3). При этом жесткость исходной воды должна быть нс более 6 мг-экв/дм3, а содержание натрия — не более 1 мг-экв/дм3.