 Дейтерий-меченый L-фенилаланин для мед диагностики
Дейтерий-меченый L-фенилаланин для мед диагностики
Дейтерий-меченый L-фенилаланин для мед диагностики ДЕЙТЕРИЙ — МЕЧЕННЫЙ L-ФЕНИЛАЛАНИН, ПРОДУЦИРУЕМЫЙ ШТАММОМ Brevibacterium methylicum ДЛЯ Мед ДИАГНОСТИКИ
2006 г. О. В. МОСИН
Столичная муниципальная академия узкой хим технологии им. М.В. Ломоносова, 117571, г. Москва, просп. Вернадского, д.86.
Представлены данные по биосинтезу [2H6] — L-фенилаланина, продуцируемого экзогенно штаммом факультативных метилотрофных микробов Brevibacterium methylicum, способного ассимилировать метанол (либо его дейтерий-меченный аналог) в качестве источника углерода и энергии. Микробную биоконверсию C2H3O2H проводили на малой среде, содержащей 98 об.% 2Н2O. Выход L-фенилаланина при всем этом составил 1 г/л. Анализ степени дейтерированности L-фенилаланина проводили способом масс-спектрометрии электрического удара после препаративного разделения способом обращенно-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ) в виде метилового эфира дансил — фенилаланина и карбобензокси-фенилаланина. Согласно приобретенным данным, степень изотопного включения дейтерия в фенилаланин составила 75 %, что свидетельствует о высочайшей эффективности мечения L-фенилаланина в этих критериях. Приобретенный [2H6]фенилаланин может быть применен для диагностики наследной фенилкетонурии.
ВВЕДЕНИЕ
Способ мечения размеренными изотопами является главным направлением в разнопрофильных биомедицинских исследовательских работах с внедрением аминокислот и других на биологическом уровне активных соединений (БАС) [1, 2]. Тенденции к желательному применению размеренных изотопов по-сравнению с радиоактивными аналогами обоснованы отсутствием радиационной угрозы и возможностью определения локализации метки в молекуле способами высочайшего разрешения, включая спектроскопию ядерного магнитного резонанса (ЯМР) [3], инфракрасную [4] и лазерную спектроскопию [5] и масс-спектрометрию (МС) [6]. Развитие этих способов детекции размеренных изотопов за последние годы позволило существенно усовершенствовать проведение бессчетных био исследовательских работ с ролью аминокислот de novo, также учить их метаболизм, механизм деяния, внутриклеточный транспорт и т.п. [7,8]. Аминокислоты, меченные размеренными изотопами 2Н, 13С, 15N обширно используются как во докторской практике и в мед диагностике, так и в биохимических исследовательских работах различного нрава [9, 10], также в хим синтезах широкого круга изотопно — меченных соединений на их базе, к примеру, меченный L-фенилаланин в синтезах пептидных гормонов и нейротрансмиттеров [11]. Изотопно-меченные аналоги L-фенилаланина находят всё большее применение в исследовательских целях, к примеру, для выявления наследной фенилкетонурии и других болезней, связанных с нарушением метаболизма аминокислот в организме [12].
В текущее время биотехнологический потенциал метилотрофных микробов для получения аминокислот, меченных дейтерием общепризнан [13]. Обычным подходом при всем этом является культивирование штаммов — продуцентов на средах, содержащих С2Н3О2Н и 2Н2О с следующим фракционированием культуральной воды. Преждевременное нами была исследована возможность использования штамма факультативных метилотрофных микробов B. methylicum для получения фенилаланина [14-15]. В отличие от обычных штаммов-продуцентов фенилаланина, у каких нарушены активности префенатдегидратазы либо дезоксиарабиногептулозофосфатсинтетазы, уникальность этого штамма заключается в том, что для биосинтеза L-фенилаланина нужен L-лейцин.
Целью данной работы было исследование принципной способности получения дейтерированного L-фенилаланина с высочайшей степенью изотопного обогащения за счёт использования штамма факультативных метилотрофных микробов Brevibacterium methylicum .
УСЛОВИЯ Опыта
Бактериальные штаммы. Исследования проводили с L-лейцин-зависимым штаммом факультативных метилотрофных микробов B. methylicum, продуцентом L-фенилаланина. Штамм был получен из коллекции культур Всероссийской коллекции промышленных микробов (ВКПМ) Муниципального научно-исследовательского института генетики и селекции промышленных микробов.
В работе использовали 2Н2O (99,9% 2Н), С2Н3О2Н (97,5 % 2Н), приобретенные из Русского научно-исследовательского центра “Изотоп” (Санкт-Петербург, РФ), также N-диметиламинонафталин-5-сульфохлорид (дансилхлорид) (Sigma, CША). Для получения производных аминокислот использовали N-диметиламинонафталин-5-сульфохлорид (дансилхлорид) (Sigma, CША), карбобензоксихлорид (химзавод им. Войкова) и диазометан. Диазометан получали из N-нитрозометилмочевины (Мerck, Германия).
Условия адаптации. Адаптацию штамма к дейтерию проводили на агаризованных средах (2 %-ный агар), содержащих тяжёлую воду. При всем этом использовали рассев культур до отдельных колоний на средах, содержащих ступенчато увеличивающиеся концентрации тяжёлой воды [9].
Культивирование микробов проводили на минеральной среде М9 [16], как описано в работе [9].
Получение дансиламинокислот культуральной воды. К 200 мг лиофилизованных препаратов культуральной воды в 5 мл 2 м. NaHCO3 (2 10-3 моль) рН 9-10 дробными порциями при смешивании добавляли 320 мг (1,2 10-3 моль) дансилхлорида в 5 мл ацетона. Обскурантистскую смесь выдерживали при смешивании при 400 С в течении часа, потом подкисляли 2 м. веществом HCL до рН 3,0 и экстрагировали этилацетатом (3 раза по 5 мл). Объединенный экстракт промывали водой до значения рН 7,0, сушили безводным сульфатом натрия, растворитель удаляли при 10 мм. рт. ст.
Дансиламинокислоты в составе белковых гидролизатов B. methylicum получали как описано в работе [9].
Получение метиловых эфиров дансиламинокислот. К 20 мл 40 %-ного КОН в 40 мл эфира добавляли 3 г увлажненной нитрозометилмочевины и размешивали на водяной бане со льдом в течении 15-20 мин. После насыщенного газовыделения эфирный слой отделяли и промывали ледяной водой до рН 7,0, сушили безводным NaSO4 и обрабатывали им препараты дансилпроизводных аминокислот в составе культуральной воды и гидролизатов белка биомассы.
Аналитическое и препаративное разделение Dns-Phe-OMe проводили способом обращённо-фазовой ВЭЖХ на жидкостном хроматографе “Knauer” (ФРГ), снабженным насосом “Knauer”, УФ-детектором “2563” и интегратором “С-R 3A” (Shimadzy, Япония). Использовали недвижную фазу: Separon SGX C 18, 7 мкм, 150 x 3,3 мм (Kova, Чехословакия). Элюирование проводили в системе растворителей: (А) — ацетонитрил-трифторуксусная кислота (20:80 об/об) и (В) — ацетонитрил. Использовали градиентное элюирование: от 20% В до 100%В в течение 30 мин, при 100% В в течение 5 мин, от 100% В до 20% В в течение 2 мин, при 20% В в течение 10 мин.
Количественное определение L-фенилаланина в культуральной воды проводили на приборе “Beckman DU6” (США) при 540 нм, после обработки препаратов культуральной воды нингидрином.
Масс-спектры электрического удара получены на приборе “MB-80A” (Hitachi, Япония) при энергии ионизирующих электронов 70 эВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение дейтерий-меченного [2H6]L-фенилаланина и масс-спектрометрический анализ. Как понятно, большая часть микробов, распространённых в природе не могут служить неплохими продуцентами аминокислот, вследствие наличия действенных устройств регуляции биосинтеза этих соединений в клеточке, хотя эта способность проявляется у ряда их мутантных форм [17]. Активными микробными продуцентами L-фенилаланина являются, обычно, мутанты, у каких снят нехороший контроль со стороны таких главных ферментов биосинтеза этой аминокислоты, как префенатдегидратаза и дезоксиарабиногептулозофосфатсинтетаза (рис.1) [18, 19].
Определённый энтузиазм в связи с этим представляет исследование возможности продуцировать L-фенилаланин лейцинзависимым метилотрофным мутантом B. methylicum, довольно комфортным, хотя и практически неизученным объектом для биотехнологического использования. Потому исходный шаг биохимических исследовательских работ со штаммом метилотрофных микробов B. methylicum был связан с получением ауксотрофных мутантов, для которых в большинстве случаях свойственны ограниченный диапазон мутантных фенотипов и не считая того достаточно высочайший уровень реверсий [20]. Начальный L-лейцинзависимый штамм B. methylicum, продуцент L-фенилаланина был отобран в лаборатории генетики метилотрофов “ГосНИИ генетики и селекции промышленных микробов” на прошлом шаге работы после обработки родительского штамма нитрозогуанидином. Скрининг подходящих клонов проводили по признаку стойкости к аналогу фенилаланина — метафторфенилаланину (50 мкг/мл). Выделенные на селективных средах аналогорезистентные мутанты конвертировали метанол и копили при всем этом фенилаланин в ферментационной среде. Сравнительные анализы (ТСХ, МС) проявили, что фенилаланин, продуцируемый данным штаммом метилотрофных микробов стопроцентно схож природному L-фенилаланину.
С целью роста эффективности изотопного мечения L-фенилаланина и интенсификации роста микробов на стопроцентно дейтерированной среде мы адаптировали приобретенный мутант B. methylicum к росту и биосинтезу в стопроцентно дейтерированных средах. К данному штамму метилотрофных микробов был применён особый подход по адаптации (таблица), который заключался в серии из 5 адаптационных пассажей начальной культуры на агаризованных средах (с добавкой 2 об. % C2HO2H) при ступенчатом увеличении концентрации тяжёлой воды в их (от 0; 24,5; 49,0; 73,5 об% до 98 об% 2Н2О). При всем этом поочередно отбирали отдельные колонии, выросшие на средах, содержащих дейтерий. Потом их пересевали на среды с большей степенью дейтерированности, включая среду с 98 об.% 2Н2О (степень выживаемости микробов на конечной стопроцентно дейтерированной среде составила 40%).
Таблица. Изотопный состав ростовых сред и биосинтетические свойства B. methylicum
Номер опыта
Составляющие среды, об.%
H2O 2H2O Метанол [U-2H]
Метанол
Лаг-период, ч
Выход микробной биомассы, % от контроля
Время генерации, ч
1
98
0
2
0
20
100
2.2
2
98
0
0
2
30
92.3
2.4
3
73.5
24.5
2
0
32
90.6
2.4
4
73.5
24.5
0
2
34
85.9
2.6
5
49.0
49.0
2
0
40
70.1
3.0
6
49.0
49.0
0
2
44
60.5
3.2
7
24.5
73.5
2
0
45
56.4
3.5
8
24.5
73.5
0
2
49
47.2
3.8
9
0
98.0
2
0
58
32.9
4.4
10
0
98.0
0
2
60
30.1
4.9
10’
0
98.0
0
2
40
87.0
2.8
Кривые, отражающие динамики роста начального и приспособленного к 2Н2О штамма B. methylicum и наибольшему уровню скопления L-фенилаланина в культуральной воды на малых средах с добавкой 2 об.% СН3ОН/С2Н3О2Н и 98 об.% 2Н2О представлены на рис. 2.
Выход биомассы, время клеточной генерации и наибольший уровень скопления L-фенилаланина в культуральной воды начальным мутантом (б) и мутантом, приспособленным к высочайшему содержанию дейтерия в среде (в) на средах, очень насыщенных дейтерием, приведены в гистограмме относительно контрольного мельчайшего организма на протонированной среде (а). Ассоциировали ростовые данные приспособленного к дейтерию мельчайшего организма и секрецию L-фенилаланина (б) с начальным B. methylicum на протонированной среде М9 (а) и на полность дейтерированной среде (98 об.% 2Н2О) с 2 об.% С2Н3О2Н (б). Как видно из представленных данных, в отсутствии дейтерий-меченных субстратов длительность лаг-фазы не превосходила 24 ч (рис. 2, а). С повышением концентрации 2Н2О в среде длительность лаг-фазы увеличивалась до 64,4 ч на средах с 98 об.% 2Н2О и 2 об.% С2Н3О2Н (рис. 2, б). Отмечено, что продолжительность времени клеточной генерации с повышением степени изотопного насыщения среды дейтерием равномерно возрастает, достигая 4,9 часов на очень дейтерированной среде (рис. 2, опыт б). Как видно из рис. 2, опыт б, С2Н3О2Н не вызывал существенного ингибирования роста и не оказывал воздействия на выходе микробной биомассы, в то время как на средах с 98 об.% 2Н2О микробный рост угнетался. Так, на среде, содержащей 98 об.% 2Н2О и 2 об.% С2Н3О2Н, выход микробной биомассы был снижен в 3,3 раза по-сравнению с контролем. Принципиально то, что, выход микробной биомассы, время клеточной генерации и уровень скопления L-фенилаланина в культуральной воды при росте приспособленного к 2H2O штамма B. methylicum на среде, содержащей 98 об.% 2Н2О и 2 об.% С2Н3О2Н меняются некординально (гист., опыт б).
Общей особенностью биосинтеза L-фенилаланина было существенное повышение его продукции на ранешней фазе экспоненциального роста B. methylicum, когда выход микробной биомассы был незначителен (рис. 3). Во всех опытах наблюдалось ингибирование биосинтеза фенилаланина на поздней фазе экспоненциального роста и понижение его концентрации в ростовых средах. Согласно данным по микроскопичному исследованию возрастающей популяции микробов, схожий нрав динамики секреции фенилаланина не коррелировал с высококачественными переменами ростовых черт культуры на разных стадиях роста, что служило доказательством морфологической однородности микробной популяции. Мы представили, что скопленный в процессе роста фенилаланин ингибировал ферменты собственного пути биосинтеза. Не считая того, мы не исключаем возможность, что при ферментации без рН-статирования может происходить оборотное перевоплощение экзогенного фенилаланина в интермедиаторные соединения его биосинтеза [21]. При обсуждении механизма биосинтеза L-фенилаланина необходимо подчеркнуть, что он синтезируется в клеточках микробов из префеновой кислоты, которая через стадию образования фенилпирувата преобразуется в фенилаланин под действием клеточных трансаминаз [22] (схема 1). Данные тонкослойной хроматографии (ТСХ) и масс-спектрометрического анализа культуральной воды проявили, что не считая L-фенилаланина данный штамм B. methylicum синтезирует и копит экзогенно другие аминокислоты: аланин, валин, лейцин, изолейцин.
Эффективность использования дансильных и Z-производных аминокислот для масс-спектрометрических исследовательских работ была показана преждевременное [10, 16]. В данной работе уровни включения изотопа 2Н в L-фенилаланин в составе культуральной воды определяли способом масс-спектрометрии электрического удара метилового эфира дансил-фенилаланина либо в виде Z-производного фенилаланина после их препаративного разделения способом обращённо-фазовой ВЭЖХ.
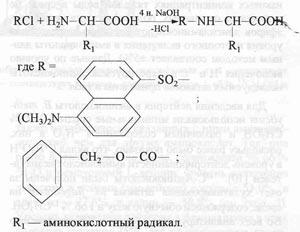 Производные аминокислот при всем этом получали прямой обработкой препаратов культуральной воды дансилхлоридом (DnsCl) либо карбобензоксихлоридом (Zcl). Реакцию проводили в щелочной среде в водно-органическом растворителе в соотношении карбобензоксихлорид (дансилхлорид)-аминокислота, равным 2:1. Летучесть дансилпроизводных аминокислот при масс-спектрометрическом анализе увеличивали за счет дополнительной дериватизации по карбоксильной группе (этерификации) диазометаном. Выбор диазометана как этерифицирующего реагента был обоснован необходимостью проведения реакции в мягеньких критериях, исключающих изотопный (1Н-2Н) обмен в ароматичных аминокислотах.
Производные аминокислот при всем этом получали прямой обработкой препаратов культуральной воды дансилхлоридом (DnsCl) либо карбобензоксихлоридом (Zcl). Реакцию проводили в щелочной среде в водно-органическом растворителе в соотношении карбобензоксихлорид (дансилхлорид)-аминокислота, равным 2:1. Летучесть дансилпроизводных аминокислот при масс-спектрометрическом анализе увеличивали за счет дополнительной дериватизации по карбоксильной группе (этерификации) диазометаном. Выбор диазометана как этерифицирующего реагента был обоснован необходимостью проведения реакции в мягеньких критериях, исключающих изотопный (1Н-2Н) обмен в ароматичных аминокислотах.
В качестве примера на рисунке показана фрагментация метилового эфира дансилфенилаланина при электрическом ударе. В масс-спектрах этого производного, обычно, верно детектируется пик молекулярного иона метилового эфира дансилфенилаланина М+. с m/z 412. Пик аминного куска А имеет невысокую интенсивность, а пик аминоацильного куска В очень низкую либо вообщем отсутствует (см. рис. 1). Не считая вышеобозначенных пиков, в масс-спектрах электрического удара Dns-Phe-OMe фиксируются пики с массовым числом m/z 250, 234, 170, которые соответствуют дансильному куску и продуктам его распада до N-диметиламинонафталина .
Масс-спектр фенилаланина, выделенный из культуральной воды, содержащей 98 об.% 2Н2О показан на рис. 4,б (диапазон приведен относительно контрольных критерий (а), где использовали обыденную воду и метанол). Из рис.2,б видно, что величина пика молекулярного иона производного фенилаланина (М+. с m/z 418,0) возрастает по сопоставлению с контрольными критериями (М+. с m/z 412,0) на 6 единиц, что составляет 75 % от полного количества атомов водорода в молекуле. Разумеется, что вышеобозначенные атомы дейтерия врубились в молекулу фенилаланина за счет процесса биосинтеза de novo, т. е. по углеродному скелету молекулы, потому что маловероятно, что они заместились в в процессе выделения аминокислоты из культуральной воды либо при хим модификации фенилаланина (протоны (дейтероны) при гетероатомах в NH2-, и -COOH группах фенилаланина за счёт лёгкости диссоциации не учитывались). Пик с m/z 432, зафиксированный в масс-спектре культуральной воды (рис.4,б) скорее всего соответствует продукту дополнительного метилирования фенилаланина по а-NH2группе. В масс-спектре фиксируется пик обогащённого дейтерием бензильного куска с m/z 97 (заместо 91 в контроле), что показывает на то, что местами локализации атомов дейтерия в молекуле фенилаланина являются положения С1-С6 ароматичных атомов и сопредельное с ними положение при углеродном атоме b. При этом, как миниум четыре из их могут быть локализованы в самом бензольном кольце молекулы фенилаланина. Приобретенный итог по степени дейтерированности фенилаланина важен для его использования в мед диагностике, где нужно использовать соединения с высочайшими степенями изотопного обогащения.
Таким макаром, в итоге легкого селекционного подхода удалось получить штамм факультативных метилотрофных микробов B. methylicum, приспособленный к высочайшему содержанию 2Н2О в ростовой среде. Преимуществами данного штамма для получения [2H6]-фенилаланина являются усовершенствованные ростовые и биосинтетические возможности этого метилотрофа на очень дейтерированной среде. За счёт использования штамма B. methylicum удалось получить около 1 грамма [2H6]-фенилаланина из 1 л культуральной воды (фенилаланин был также выделен из культуральной воды B. methylicum способом обращенно-фазовой ВЭЖХ в виде метилового эфира дансил-L-фенилаланина со степенью хроматографической чистоты 99 % и выходом 89 %). В заключение необходимо подчеркнуть, что более высочайшая эффективность мечения фенилаланина может быть обеспечена за счёт полной подмены протонированных солей в составе ростовой среды на их дейтерированые аналоги, также используя лейцин, униформно меченный дейтерием, который в принципе можно выделять из гидролизатов суммарных белков биомассы данного мельчайшего организма.
ЛИТЕРАТУРА
1. Patel G.B., Sprott G.D., Ekiel I. // Appl. Environ. Microbiol. — 1993. — V. 59. — N. 4. — P. 1099-1103.
2. John Colby, Howard Dalton. // Ann. Rev. Microbiol. — 1979. — V. 33. — P. 481-517.
3. Skladnev D.A., Baev M.V., Shilova S.Yu., et al. // Proceedings of 6th Europ. Conf. on Biomass for Energy. — Industry and Environment. — Athens. — 1991. — P. 47-51.
4. Katz J., and Crespi H. L. // Pure Appl. Chem. — 1972. — V. 32. — P. 221-250.
5. Crespi H. L. // Biosynthesis and uses of per-deuterated proteins. in: Synthesis and Applications of Isotopically labeled Compounds, Proceedings of the Second Inter. Symp. — Elsevier. — 1986. — P. 111-112.
6. Karnaukhova E.N., Reshetova O.S., Semenov S.Y., Skladnev D.A., Tsygankov Y.D. // Amino Acids. — 1994. — V. 6. — P. 165-176.
7. Мосин О.В., Карнаухова Е.Н., Пшеничникова А.Б.,Складнев Д.А., Акимова О.Л. // Биотехнология. — 1993. — N. 9. — С. 16-20.
8. Егорова Т.А., Мосин О.В., Еремин С.В., Карнаухова Е.Н.,Звонкова Е.Н., Швец В.И. // Биотехнология. — 1993. — N. 8. — С. 21-25.
9. Karnaukhova E.N., Mosin O.V., Reshetova O.S. // Amino Acids. — 1993. — V. 5. — P. 125.
10. Мосин О.В., Складнев Д.А., Егорова Т.А., Юркевич А.М., Швец В.И. // Биотехнология. — 1996. — N. 3. (в печати).
11. Миллер Дж. Опыты в молекулярной генетике. — М.: Мир, — 1976. — С. 393.
12. Звонкова Е.Н., Зотчик Н.В., Филлипович Е.И., Митрофанова Т.К., Мягкова Г.И., Серебренникова Г.А // Химия на биологическом уровне активных природных соединений. — М.: Химия, 1970. — С. 65-68.
13. Bligh E.G., Dyer W.J. // Can. J. Biochem. Physiol. — 1959. — V. 37. — N. 8. — P. 911-918.
14. Егорова Т.А., Ерёмин С.В., Митснер Б.И., Звонкова Е.Н., Швец В.И. // Биотехнология. — N5. — 1993. — С. 30-35.
15. Egorova T.A., Eremin S.V., Mitsner B.I., Zvonkova E.N., Shvets V.I. // J. of Chromatography B. — 1995. — V. 665. — P. 53-62.
16. Daniely B. et al. // J. Org. mass spectrometry. — 1989. — 24. — P. 225-229.
Oleg V. Mosin
Department of Biotechnology, M. V. Lomonosov State Academy of Fine Chemical Technology, Vernadskogo Prospekt 86, 117571, Moscow, Russia
Deuterium labelled L-phenylalanine prodused by methylotrophic bacterium Brevibacterium methylicum for biomedical diagnostics.
The data on biosynthesis [2H6] — L-phenylalanine, produced by facultative methylotrophic bacteria Brevibacterium methylicum, capable to assimilate methanol (or its deuterated analogue) as a source of carbon and energy are submitted. Microbic bioconversion of deuterated methanol was carried out on the minimal growth medium containing 98 % of heavy water. The level of L-phenylalanine output has мейд 1 gramm from 1 liter of growth medium. The analysis of deuterium enrichment level was carried out with using a method of electron impact mass-spectrometry after preparative separation of methyl ether of N-Dns-Phenylalanine by a method of inverted — phase highly effective liquid chromatography. According to the received data, the degree of isotope inclusion of deuterium into molecule of phenylalanine has мейд 75 % that testifies to high efficiency of deuterium labelling of phenylalanine in these conditions. Biosynthetically received [2H6] — phenylalanine can be used for biomedical diagnostic studies.