 Формирование кластеров воды
Формирование кластеров воды
Формирование кластеров воды
К.х.н. О. В. Мосин
КАК ФОРМИРУЮТСЯ КЛАСТЕРЫ ВОДЫ?
Если совершить лаконичный экскурс в школьный курс химии мы вспомним, что две электрические пары образуют полярные ковалентные связи меж атомами водорода и кислорода, а оставшиеся две электрические пары остаются свободными и именуются неподеленными. Молекула воды имеет угловое строение, угол Н–О–Н составляет 104,5 градусов.
Рис. Молекула воды
Так как у атома кислорода больше электронов (химики молвят, что атом кислорода более электроотрицательный), чем у атома водорода, электроны 2-ух атомов водорода сдвигаются в сторону более электроотрицательного атома кислорода, приводя к тому, что два положительных заряда атомов водорода компенсируются равным по величине двум атомов водорода отрицательным зарядом атома кислорода. Потому электрическое скопление имеет неоднородную плотность. Около ядер водорода имеется недочет электрической плотности, а на обратной стороне молекулы, около ядра кислорода, наблюдается излишек электрической плотности. Это приводит к тому, что молекула воды представляет собой небольшой диполь, содержащий положительный и отрицательный заряды на полюсах. Конкретно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится большая геометрическая фигура — верный тетраэдр. Но таковой тетраэдр – это только самый 1-ый базисный уровень строения воды.
Рис. Структура молекулы воды: а) угловая; б) шаровая; в) тетраэдрическая
2-ой уровень хим организации воды определяется возможностью тетраэдров воды создавать особенные связи, нареченные водородными связями, которые связывают отдельные молекулы вместе в ассоциаты.
Водородная связь имеет глобальное значение в химии межмолекулярных взаимодействий и обоснована в главном слабенькими электростатическими силами и воздействиями. Она появляется при содействии обедненного электронами атома водорода одной молекулы воды с неподеленной электрической парой атома кислорода примыкающей молекулы воды.
Рис. Образование водородной связи
Водородная связь намного слабее ковалентной связи, все же играет очень важную роль во внутримежмолекулярных взаимодействиях. Водородные связи почти во всем обусловливают аномальные физические характеристики воды. К примеру, если рассматривать воду как ординарную совокупа молекул Н2О, то оказывается, что её удельный вес должен составлять 1,84 г/см3, а температура её кипения будет равна 63,5°С. Но, как понятно, при обычной температуре и давлении удельный вес воды равен 1 г/см3, а бурлит вода при 100°С. Исходя из этого, следует представить, что снутри воды должны быть пустоты, где нет молекул Н2О, другими словами воде присуща особенная структура. Это принципное открытие было изготовлено английским физиком Берналом. С того времени в этой области проведено огромное количество исследовательских работ, но полной ясности в этом вопросе еще как бы нет.
Отличительная черта водородной связи – сравнимо низкая крепкость, ее энергия в 5–10 раз ниже, чем энергия хим связи. По энергии она занимает среднее положение меж хим связями и Ван-дер-ваальсовыми взаимодействиями, теми, что задерживают молекулы в жесткой либо водянистой фазе.
Так как любая молекула воды имеет четыре центра образования водородной связи (две неподелённые электрические пары у атома кислорода и два атома водорода), то любая молекула воды способна создавать водородные связи с 4-мя молекулами воды, образуя ажурный сетчатый каркас в молекуле льда.
Рис. Любая молекула воды способна создавать водородные связи с 4-мя примыкающими молекулами
В кристаллической структуре льда любая молекула участвует в 4 водородных связях, направленных к верхушкам тетраэдра. В центре этого тетраэдра находится атом кислорода, в 2-ух верхушках — по атому водорода, электроны которых задействованы в образовании ковалентной связи с кислородом. Две оставшиеся верхушки занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей.
Рис. Водородные связи в кристаллической решётке льда
В отличие от льда, в водянистой воде водородные связи просто разрушаются и стремительно восстанавливаются, что делает структуру воды только изменчивой. Конкретно благодаря этим связям в отдельных микрообъемах воды безпрерывно появляются типичные ассоциаты воды — её структурные элементы. Всё это приводит к неоднородности в структуре воды.
Первым идею о том, что вода неоднородна по собственной структуре, высказал Уайтинг в 1884 году. Его авторство цитирует Э.Ф. Фрицман в монографии “Природа воды. Тяжёлая вода”, изданной в 1935 году. После неё появилось огромное количество работ, в которых воду рассматривали как смесь ассоциатов различного состава (“гидролей”).
Когда в 20-е годы обусловили структуру льда, оказалось, что молекулы воды в кристаллическом состоянии образуют трёхмерную непрерывную сетку, в которой любая молекула имеет четырёх ближайших соседей, расположенных в вершинах правильного тетраэдра. В 1933 году Дж. Бернал и П. Фаулер представили, что схожая сетка существует и в жидкой воде. Так как вода плотнее льда, они считали, что молекулы в ней размещены не так, как во льду, то есть подобно атомам кремния в минерале тридимите, а так, как атомы кремния в более плотной модификации кремнезёма — кварце. Повышение плотности воды при нагревании от 0 до 4°C разъяснялось присутствием при низкой температуре тридимитовой составляющие. Таким макаром, модель Бернала — Фаулера сохранила элемент двухструктурности, но главное их достижение — мысль непрерывной тетраэдрической сетки. Тогда появился известный афоризм И. Ленгмюра: „Океан — одна большая молекула“.
Исключительно в 1951 году Дж. Попл сделал модель непрерывной сетки, которая была не так конкретна, как модель Бернала — Фаулера. Попл представлял воду как случайную тетраэдрическую сетку, связи меж молекулами в которой искривлены и имеют различную длину. Модель Попла разъясняет уплотнение воды при плавлении искривлением связей. Когда в 60–70-е годы появились 1-ые определения структуры льдов II и IX, стало ясно, как искривление связей может приводить к уплотнению структуры. Модель Попла не могла разъяснить немонотонность зависимости параметров воды от температуры и давления так отлично, как модели 2-ух состояний. Потому идею 2-ух состояний ещё длительно делили многие учёные.
Рис. Модель непрерывной сетки
Во 2-ой половине XX века кроме „континуальных“ моделей (модель Попла), появились две группы „смешанных“ моделей: кластерные и клатратные. В первой группе вода представала в виде кластеров из молекул, связанных водородными связями, которые плавали в море молекул, в таких связях не участвующих. Модели 2-ой группы рассматривали воду как непрерывную сетку водородных связей — каркас, которая содержит пустоты; в них располагаются молекулы, не образующие связей с молекулами каркаса.
Посреди кластерных моделей более броской оказалась модель Г. Немети и Х. Шераги, предложенные ими рисунки, изображающие кластеры связанных молекул, которые плавают в море несвязанных молекул, вошли во множество монографий.
Другая модель воды, предложенная в 1957 г. Фрэком и Уэном – модель мерцающих кластеров. Эта модель очень близка современным представлениям о структуре воды. В этой модели водородные связи в воде безпрерывно образуются и рвутся, при этом эти процессы протекают кооперативно в границах короткоживущих групп молекул воды, нареченных “мерцающими кластерами”. Их время жизни оценивают в спектре от 10-10 до 10-11 с. Такое представление правдоподобно разъясняет высшую степень подвижности водянистой воды и ее низкую вязкость. Считается, что благодаря конкретно таким свойствам вода служит одним из самых универсальных растворителей.
Рис. Модель мерцающих кластеров воды. На рисунке представлены как отдельные кластерно-ассоциативные структуры молекул воды, так и отдельные молекулы воды, не связанные водородными связями.
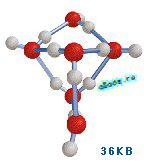 Итак, вода – это огромный полимер огромного количества молекул воды, связанных вместе водородными связями. Но традиционный полимер – это молекула, все атомы которой объединены ковалентными связями, а не водородными, которые до недавнешнего времени числились чисто электростатическими. Но в 1999 г. было экспериментально показано, что водородная связь меж молекулами воды во льду имеет отчасти (на 10%) ковалентный нрав [Isaacs E. D., et al.,1999]. Даже отчасти ковалентный нрав водородной связи “разрешает”, само мало, 10% молекул воды объединяться в полимерные устойчивые ассоциаты.
Итак, вода – это огромный полимер огромного количества молекул воды, связанных вместе водородными связями. Но традиционный полимер – это молекула, все атомы которой объединены ковалентными связями, а не водородными, которые до недавнешнего времени числились чисто электростатическими. Но в 1999 г. было экспериментально показано, что водородная связь меж молекулами воды во льду имеет отчасти (на 10%) ковалентный нрав [Isaacs E. D., et al.,1999]. Даже отчасти ковалентный нрав водородной связи “разрешает”, само мало, 10% молекул воды объединяться в полимерные устойчивые ассоциаты.
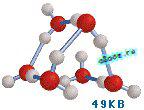 В 1993 году южноамериканский химик Кен Джордан предложил свои варианты кластеров — устойчивых “ассоциатов воды”, которые состоят из 6 её молекул [Tsai & Jordan, 1993]. Эти кластеры могут объединяться вместе и со “свободными” молекулами воды за счет экспонированных на их поверхности водородных связей. Увлекательной особенностью этой модели будет то, что из нее автоматом следует, что свободно растущие кристаллы воды, отлично известные нам снежинки, должны владеть 6-лучевой симметрией.
В 1993 году южноамериканский химик Кен Джордан предложил свои варианты кластеров — устойчивых “ассоциатов воды”, которые состоят из 6 её молекул [Tsai & Jordan, 1993]. Эти кластеры могут объединяться вместе и со “свободными” молекулами воды за счет экспонированных на их поверхности водородных связей. Увлекательной особенностью этой модели будет то, что из нее автоматом следует, что свободно растущие кристаллы воды, отлично известные нам снежинки, должны владеть 6-лучевой симметрией.
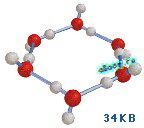 В 2002 году группе д-ра Хэд-Гордона способом рентгеноструктурного анализа при помощи сверхмощного рентгеновского источника Advanced Light Source (ALS) удалось показать, что молекулы воды способны за счет водородных связей создавать структуры — «настоящие кирпичики» воды, представляющие из себя топологические цепочки и кольца из огромного количества молекул воды. Интерпретируя приобретенные экспериментальные данные, исследователи считают их достаточно долгоживущими элементами структуры. В главном же вода – это совокупа хаотичных полимеров и гипотетичных «водяных кристаллов» (которые, как предполагаются есть в талой воде), где количество связанных в водородные связи молекул может достигать сотен и даже тыщ единиц.
В 2002 году группе д-ра Хэд-Гордона способом рентгеноструктурного анализа при помощи сверхмощного рентгеновского источника Advanced Light Source (ALS) удалось показать, что молекулы воды способны за счет водородных связей создавать структуры — «настоящие кирпичики» воды, представляющие из себя топологические цепочки и кольца из огромного количества молекул воды. Интерпретируя приобретенные экспериментальные данные, исследователи считают их достаточно долгоживущими элементами структуры. В главном же вода – это совокупа хаотичных полимеров и гипотетичных «водяных кристаллов» (которые, как предполагаются есть в талой воде), где количество связанных в водородные связи молекул может достигать сотен и даже тыщ единиц.
«Водяные кристаллы» могут иметь самую разную форму, как пространственную, так и двухмерную (в виде кольцевых структур). В базе же всего лежит тетраэдр. Конкретно такую форму имеет молекула воды. Группируясь, тетраэдры молекул воды образуют разнообразные пространственные и плоскостные структуры. И из всего обилия структур в природе базисной является гексагональная (шестигранная) структура, когда 6 молекул воды (тетраэдров) соединяются воединыжды в кольцо. Таковой тип структуры характерен для льда, снега и талой воды.
Рис. Кристаллическая структура льда
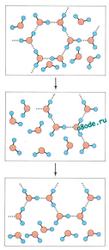 Когда лёд плавится, его тетрагональная структура разрушается и появляется смесь кластеров, состоящая из три-, тетра-, пента-, и гексамеров воды и свободных молекул воды. Схематически этот процесс можно представить для себя так.
Когда лёд плавится, его тетрагональная структура разрушается и появляется смесь кластеров, состоящая из три-, тетра-, пента-, и гексамеров воды и свободных молекул воды. Схематически этот процесс можно представить для себя так.
Рис. справа — Структура водянистой воды. В воде кластеры временами разрушаются и образуются опять. Время перескока составляет 10-12 секунд.
Изучить строение этих образующихся ассоциатов оказалось достаточно трудно, так как вода – смесь разных полимеров, которые находятся в равновесии меж собой.
Сталкиваясь вместе, полимеры перебегают один в другой, распадаются и вновь образуются.
Поделить эту смесь на отдельные составляющие тоже фактически нереально.
Только в 1993 году группа исследователей из Калифорнийского института (г. Беркли, США) под управлением доктора Р.Дж.Сайкалли расшифровала строение триммера воды, в 1996 г. – тетрамера и пентамера, а потом и гексамера воды. К этому времени уже было установлено, что водянистая вода состоит из полимерных ассоциатов (кластеров), содержащих от 3-х до 6 молекул воды.
Более сложным оказалось строение гексамера. Самая обычная структура – 6 молекул воды в верхушках шестиугольника, – как выяснилось, не настолько высокопрочна, как структура клеточки.
Более того, структуры призмы, раскрытой книжки либо лодки тоже оказались наименее устойчивыми. В шестиугольнике может быть только 6 водородных связей, а экспериментальные данные молвят о наличии восьми. Это означает, что четыре молекулы воды связаны перекрёстными водородными связями.
Структуры кластеров воды были найдены и на теоретическом уровне, нынешняя вычислительная техника позволяет это сделать. В 1999 г. Станислав Зенин провёл вместе с Б. Полануэром (на данный момент в США) исследование воды в ГНИИ генетики, которые дали наинтереснейшие результаты.
Применив современные способы анализа — рефрактометрию, протонный резонанс и жидкостную хроматографию им удалось найти ассоциаты молекул воды — кластеры.
Рис. Вероятные кластеры водыРис. Формирование кластера из 20 молекулы воды.
Объединяясь вместе, кластеры могут создавать более сложные структуры:
Рис. Более сложные ассоциаты кластеров воды
 Кластеры, содержащие в своём составе 20 молекулу оказались более размеренными.
Кластеры, содержащие в своём составе 20 молекулу оказались более размеренными.
Анализируя приобретенные данные С.В. Зенин предложил, что вода представляет собой иерархию правильных больших структур «ассоциатов» (clathrates), в базе которых лежит кристаллоподобный «квант воды», состоящий из 57 ее молекул, которые ведут взаимодействие вместе за счет свободных водородных связей. При всем этом 57 молекул воды (квантов), образуют структуру, напоминающую тетраэдр. Тетраэдр в свою очередь состоит из 4 додекаэдров (правильных 12-гранников). 16 квантов образуют структурный элемент, состоящий из 912 молекул воды. Вода на 80% состоит из таких частей, 15% — кванты-тетраэдры и 3% — традиционные молекулы Н2О. Таким макаром, структура воды связана с так именуемыми платоновыми телами (тетраэдр, додекаэдр), форма которых связана с золотой пропорцией. Ядро кислорода также имеет форму платонова тела (тетраэдра).
Простой ячейкой воды являются тетраэдры, содержащие связанные меж собой водородными связями четыре (обычный тетраэдр) либо 5 молекул Н2О (объемно-центрированный тетраэдр).
Рис. Тетраэдр
При всем этом у каждой из молекул воды в обычных тетраэдрах сохраняется способность создавать водородные связи. За счет их обыкновенные тетраэдры могут объединяться меж собой верхушками, ребрами либо гранями, образуя разные кластеры со сложной структурой, к примеру, в форме додекаэдра.
Рис. Додекаэдр
Таким макаром, в воде появляются бессчетные кластеры, которые несут внутри себя очень огромную энергию и информацию очень высочайшей плотности. Порядковое число таких структур воды так же высоко, как и порядковое число кристаллов (структура с очень высочайшим упорядочением, которую мы только знаем), поэтому их также именуют «жидкими кристаллами» либо «кристаллической водой». «Кванты воды» могут вести взаимодействие вместе за счет свободных водородных связей, торчащих наружу из вершин “кванта” своими гранями. При всем этом может быть образование уже 2-ух типов структур второго порядка. Их взаимодействие вместе приводит к возникновению структур высшего порядка. Последние состоят из 912 молекул воды, которые по модели Зенина фактически не способны к взаимодействию за счет образования водородных связей. Этим и разъясняется, к примеру, высочайшая текучесть воды, состоящей из большенных полимеров. Таким макаром, аква среда представляет собой вроде бы иерархически организованный водянистый кристалл.
Рис. справа — Формирование отдельного кластера воды (компъютерное моделирование)
Изменение положения 1-го структурного элемента в этом кристалле под действием хоть какого наружного фактора либо изменение ориентации окружающих частей под воздействием добавляемых веществ обеспечивает, согласно догадке Зенина, высшую чувствительность информационной системы воды. Если степень возмущения структурных частей недостаточна для перестройки всей структуры воды в данном объеме, то после снятия возмущения система через 30-40 мин ворачивается в начальное состояние. Если же перекодирование, т. е. переход к другому обоюдному расположению структурных частей воды оказывается энергетически прибыльным, то в новеньком состоянии отражается кодирующее действие вызвавшего эту перестройку вещества [Зенин, 1994]. Такая модель позволяет Зенину объясненить «память воды» и ее информационные характеристики [Зенин, 1997].
К.х.н. О. В. Мосин
Cписок литературы:
Г.Г. Маленков. Успехи физической химии, 2001
С.В.Зенин, Б.М. Полануер, Б.В. Тяглов. Экспериментальное подтверждение наличия фракций воды. Ж. Гомеопатическая медицина и акупунктура. 1997.№2.С.42-46.
С.В. Зенин, Б.В. Тяглов. Гидрофобная модель структуры ассоциатов молекул воды. Ж.Физ.химии.1994.Т.68.№4.С.636-641.
С.В. Зенин Исследование структуры воды способом протонного магнитного резонанса. Докл.РАН.1993.Т.332.№3.С.328-329.
С.В.Зенин, Б.В.Тяглов. Природа гидрофобного взаимодействия. Появление ориентационных полей в аква смесях. Ж.Физ.химии.1994.Т.68.№3.С.500-503.
С.В. Зенин, Б.В. Тяглов, Г.Б.Сергеев, З.А. Шабарова. Исследование внутримолекулярных взаимодействий в нуклеотидамидах способом ЯМР. Материалы 2-й Всесоюзной конф. По динамич. Стереохимии. Одесса.1975.с.53.