 Исследование уровней включения изотопов 2Н- и 13С в секретируемые аминокислоты метилотрофных микробов
Исследование уровней включения изотопов 2Н- и 13С в секретируемые аминокислоты метилотрофных микробов
Исследование уровней включения изотопов 2Ни 13С в секретируемые аминокислоты метилотрофных микробов
Эффективность использования дансильных и Z-производных аминокислот для масс-спектрометрических исследовательских работ была показана преждевременное [10, 16]. В данной работе уровни включения изотопов 2Н-и 13С в мультикомпонентные консистенции аминокислот в составе культуральной воды и белковых гидролизатов определяли способом масс-спектрометрии электрического удара метиловых эфиров дансил-аминокислот либо в виде Z-производных аминокислот после их препаративного разделения способом обращённо-фазовой ВЭЖХ.
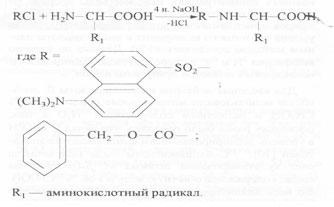 Производные аминокислот получали прямой обработкой препаратов культуральной воды и гидролизатов суммарных белков биомассы карбобензоксихлоридом (ZCl) либо дансилхлоридом (DnsCl) и диазометаном (CH2N2). Реакцию проводили в щелочной среде в водно-органическом растворителе в соотношении карбобензоксихлорид (дансилхлорид)-аминокислота, равным 2:1 (схема 1).
Производные аминокислот получали прямой обработкой препаратов культуральной воды и гидролизатов суммарных белков биомассы карбобензоксихлоридом (ZCl) либо дансилхлоридом (DnsCl) и диазометаном (CH2N2). Реакцию проводили в щелочной среде в водно-органическом растворителе в соотношении карбобензоксихлорид (дансилхлорид)-аминокислота, равным 2:1 (схема 1).
Для лизина, гистидина, тирозина, серина, треонина и цистеина вместе с монопроизводными было типично образование ди-Z-(Dns)-производных: ди-Z,(Dns)-лизина, ди-Z,(Dns)-гистидина, О,N-ди-Z,(Dns)-тирозина, O,N-ди-Z,(Dns)-серина, O,N-ди-Z,(Dns)-треонина и N,S-ди-Z,(Dns)-цистеина (на схеме 1 эти произодные не показаны). Не считая этого, из аргинина синтезировался три-Z,(Dns)-аргинин.
Летучесть дансилпроизводных аминокислот при масс-спектрометрическом анализе увеличивали за счет дополнительной дериватизации по карбоксильной группе (этерификации) диазометаном. Выбор диазометана как этерифицирующего реагента был обоснован необходимостью проведения реакции в мягеньких критериях, исключающих изотопный (1Н-2Н) обмен в ароматичных аминокислотах.
Данные масс-спектрометрии по уровням включения размеренных изотопов 2Н-и13С в бензилоксикарбонильные производные аминокислот в границах схожих концентраций тяжёлой воды в среде не отличались от таких, приобретенных для метиловых эфиров дансиламинокислот (точность определения уровней изотопного включения в аминокислоты данным способом составляет +5). Данные по уровням включения 2Н-и 13С секретируемые аминокислоты исследуемых штаммов приведены в таблице 3. Для введения дейтерия в аминокислоты B. methylicum использовали малые среды с 2 об.% СН3ОН и разным содержанием 2Н2О в их, так как преждевременное было показано, что вклад С2Н3О2Н в уровни дейтерированности аминокислот незначителен [10].
13С-аминокислоты были получены за счёт культивирования штамма M. flagellatum на среде, содержащей обыденную воду и 1 об.% к 13CH3OH. Во всех анализируемых образчиках культуральной воды не зависимо от рода штамма присутствовали аланин, валин, лейцин (изолейцин) и фенилаланин (см. табл. 3). В культуральной воды M. flagellatum в дополнение вышеназванным аминокислотам также скапливался глицин.
Таблица 3.
Уровни включения 2Н и 13С в секретируемые аминокислоты B. methylicum и M. flagellatum (данные получены для Z-,и Dns-производных аминокислот)*.
Аминокислоты
Содержание 2Н2О в среде, об%
24,5 49,0 73,5 98,0
1 % 13СН3ОН
Глицин
—
—
—
—
60,0
Аланин
24,0
37,5
62,5
77,5
35,0
Валин
20,0
46,3
43,8
58,8
50,0
Лейцин (изолейцин)
15,0
47,0
46,0
51,0
38,0
фенилаланин
15,0
27,5
51,3
75,0
95,0
* Данные по включению 2Н в аминокислоты приведены для B. methylicum при росте на средах, содержащих 2 об.% CH3OH и 24,5; 49,5; 73,5; 98,0 об.% 2Н2О.
Данные по включению 13С приведены для M. flagellatum при росте на среде, содержащей 1 об.% 13СН3ОН и 99 об.% Н2О.
Во всех опытах наблюдалось специфическое возрастание уровней изотопного включения дейтерия в личные аминокислоты культуральной воды при ступенчатом увеличении концентраций тяжёлой воды в ростовой среде (табл. 3). Как видно из таблицы 3, для аминокислот из культуральной воды, количество включенных атомов дейтерия по углеродному скелету молекулы варьирует в границах 49 об.%-ной концентрации 2Н2O и составляет для фенилаланина 27,5%, аланина — 37,5%, валина — 46,3%, лейцина (изолейцина) — 47%.
Как и следовало ждать, для получения 13С-аминокислот за счет микробной биоконверсии 13СН3ОН, подготовительная адаптация не является нужным шагом, так как этот изотопный субстрат не оказывает существенного воздействия на ростовые и биосинтетические свойства метилотрофов. Масс-спектр культуральной воды M. flagellatum, приобретенной после обработки дансилхлоридом и диазометаном со среды, содержащей 1 об.% 13СН3ОН и 99 об.% Н2О показан на рис. 2,б (Масс-спектр приведён относительно контрольных критерий, где использовали обыденную воду и метанол (а)). Как видно из рис. 2,б, в дериватизованной культуральной воды М. lagellatum детектируются обогащённые изотопом 13С пики молекулярных ионов производных аминокислот с М+. при m/z 337,4; 368,5; 382,3; 420,5, которые соответствуют по массе аланину, валину, лейцину (изолейцину) и фенилаланину. Потому что дела массы к заряду m/z для лейцина (изолейцина) в масс-спектрах электрического удара метиловых эфиров дансиламинокислот совпадают, то вследствие этого нельзя точно идентифицировать структуру соединения данным способом. Не считая вышеназванных пиков молекулярных ионов, в масс — диапазоне фиксируется пик с М+. при m/z 323,2 (заместо m/z 322,0 в контроле), соответственный метиловому эфиру дансил-глицина.
В связи с тем, что штамм B. methylicum был ауксотрофом по лейцину, а другой штамм M. flagellatum — ауксотрофом по изолейцину, было любопытно изучить как меняются уровни включения дейтерия в этих аминокислотах. Для этого лейцин добавляли в ростовую среду B. methylicum, приготовленную на базе 98 об.% 2Н2О в немеченном виде. В случае с M. flagellatum изолейцин добавляли в среду, приготовленную из обыкновенной воды и 1 об.% 13СН3ОН. Как проявили наши исследования, в критериях ауксотрофности по лейцину (изолейцину) уровень изотопного обогащения лейцина (изолейцина), также метаболически связанных с ними аминокислот ниже, чем для других аминокислот. Так, при росте B. methylicum на среде, содержащей 98 об.% 2Н2О и немеченный L-лейцин, уровни включения дейтерия в лейцин (изолейцин) составили 51,0%, аланин — 77,5%, валин — 58,8% (табл. 3). Уровень включения дейтерия в фенилаланин в этих критериях составил 75%. Эта же особенность проявляется при росте M. flagellatum на среде с 1 об.% 13СН3ОН и добавкой немеченного L-изолейцина. Как видно из таблицы 3, в отличие от фенилаланина (уровень изотопного обогащения — 95%), уровни включения изотопа 13С в лейцин (изолейцин), аланин и валин составили 38,0; 35,0; 50,0 % соответственно. Уровень изотопного обогащения глицина составил 60%. Суммируя приобретенные данные, можно прийти к выводу о сохранении минорных путей метаболизма, связанных с биосинтезом лейцина (изолейцина) de novo.