 Метастабильная вода
Метастабильная вода
Метастабильная вода
К.х.н. О.В. Мосин
МЕТАСТАБИЛЬНАЯ ВОДА
В физической химии размеренной либо сбалансированной фазой именуется такое состояние вещества, которое отвечает минимуму минимуму свободной энергии Гиббса при условии, что наружные условия задаются температурой и давлением. Вещество может существовать и в состоянии, не отвечающем минимуму энергии, тогда и оно именуется метастабильной фазой. Метастабильная фаза соответствует локальному минимуму энергии в пространстве координат. Такое состояние отделено от размеренной фазы, соответственной более глубочайшему энергетическому минимуму, конечным энергетическим барьерам.
Так как всегда существует ненулевая возможность преодоления барьера и перевоплощения метастабильной фазы в размеренную (либо в другую метастабильную, лежащую ниже по энергии), то все метастабильные фазы имеют нескончаемое время существования — «время жизни».
Если при изменении температуры либо давления свободные энергии Гиббса для 2-ух фаз 1-го и такого же вещества становятся равными по величине, то может произойти фазовый переход – в ту фазу, которая при предстоящем изменении наружных характеристик будет иметь наименьшее значение энергии. Примеры таких процессов – плавление, кипение и перестройки кристаллической решетки, к примеру перевоплощение льда в воду. Фазовые переходы могут происходить как меж размеренными, так и меж метастабильными фазами.
Невзирая на огромные времена жизни многих жестких метастабильных фаз при обычных критериях, за нескончаемые времена они безизбежно перейдут в постоянные сбалансированные состояния – к примеру, все стекла закристаллизуются.
При изменении температуры и давления время жизни метастабильных фаз также может значительно поменяться. Алмаз при обычном давлении и комнатной температуре живет фактически вечно, при нагревании до 1000 С в инертной среде преобразуется в размеренную при атмосферном давлении фазу углерода – графит – за месяцы, а при 1200 С – за часы. Большая часть стекол и бесформенных жестких тел при обычных критериях живут очень длительно, а при нагревании стремительно кристаллизуются.
Подавляющее большая часть природных веществ относятся к метастабильным, другими словами отвечают локальному, не самому глубочайшему минимуму из всех вероятных для данного хим состава. К примеру, фактически все сложные вещества, состоящие из огромных органических молекул, метастабильны. Любопытно также, что практически все обыкновенные молекулярные вещества, такие, как углеводороды, гидриды, карбиды и оксиды азота, окись углерода, спирты, глицерин и др., при обычном давлении также представляют собой метастабильные фазы. Другими словами исходя из убеждений сбалансированной термодинамики этих веществ не существует. Размеренны только несколько соединений — метан СH4, аммиак NH3 , углекислый газ СO2, вода H2O. Все другие молекулярные вещества, состоящие из углерода, водорода, кислорода и азота, за довольно огромное время должны безизбежно разложиться на смесь соединений из этой четверки и незапятнанных простых веществ. К примеру, хоть какой углеводород — этилен, метилен, ацетилен, бензол — перейдет в смесь графита и метана; окись углерода СО — в смесь СO2 и графита.
Всем известные примеры метастабильных фаз – переохлажденная и перегретая жидкость и переохлажденный пар. Время жизни таких метастабильных фаз всего сильно мало, хотя бывают исключения. К примеру, глицерин ниже 20 С только медлительно кристаллизуется. Переохлажденная вода в отсутствие механических воздействий сохраняет свою структуру.
Известны примеры жестких метастабильных фаз с временем жизни, при обычных критериях существенно превосходящем возраст Вселенной. К таким субстанциям относятся, к примеру, алмаз, кварцевое стекло, белоснежный фосфор.
Другой пример метастабильного состояния вещества – отлично всем узнаваемый лёд, который имеет 14 модификаций, некие из которых метастабильные.
Табл. — Некие данные о структурах модификаций льда
Модифи
кация
Сингония
Фёдоровская группа
Длины водородных связей,
Углы О—О—О в тетраэдрах
I
Ic
II
III
V
VI
VII
VIII
IX
Гексагональная
Кубическая
Тригональная
Тетрагональная
Моноклинная
Тетрагональная
Кубическая
Кубическая
Тетрагональная
P63/mmc
F43m
R3
P41212
A2/a
P42/nmc
Im3m
Im3m
P41212
2,76
2,76
2,75—2,84
2,76—2,8
2,76—2,87
2,79—2,82
2,86
2,86
2,76—2,8
109,5
109,5
80—128
87—141
84—135
76—128
109,5
109,5
87—141
Примечание. 1 A=10-10 м.
Лёд – кристаллическая модификация воды. По последним данным лёд имеет 14 структурных модификаций. Посреди их есть и кристаллические (их большая часть) и бесформенные модификации, но они все отличаются друг от друга обоюдным расположением молекул воды и качествами. Правда, все, не считая обычного нам льда, кристаллизующего в гексагональной сингонии, образуются в критериях экзотичных — при очень низких температурах и больших давлениях, когда углы водородных связей в молекуле воды меняются и образуются системы, хорошие от гексагональной. Такие условия напоминают галлактические и не встречаются на Земле. К примеру, при температуре ниже –110 °С водяные пары выпадают на железной пластинке в виде октаэдров и кубиков размером в несколько нанометров — это так именуемый кубический лед. Если температура чуток выше –110 °С, а концентрация пара очень мала, на пластинке формируется слой только плотного бесформенного льда.
Кристаллическая структура льда похожа на структуру алмаза: любая молекула Н2O окружена 4-мя наиблежайшими к ней молекулами, находящимися на схожих расстояниях от нее, равных 2,76 ангстрем и размещенных в верхушках правильного тетраэдра. В связи с низким координационным числом структура льда является сетчатой, что оказывает влияние на его невысокую плотность.
Рис. Структура льда.
Разгадка структуры льда заключается в строении его молекулы. Кристаллы всех модификаций льда построены из молекул воды H2O, соединённых водородными связями в трёхмерный каркас. Молекулу воды можно упрощенно представить для себя в виде тетраэдра (пирамиды с треугольным основанием). В её центре находится атом кислорода, в 2-ух верхушках — по атому водорода, электроны которых задействованы в образовании ковалентной связи с кислородом. Две оставшиеся верхушки занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей, потому их именуют неподеленными.
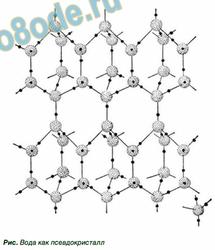
Рис.1. Структура льда I.
Любая молекула участвует в 4 таких связях, направленных к верхушкам тетраэдра. При содействии протона одной молекулы с парой неподеленных электронов кислорода другой молекулы появляется водородная связь, наименее мощная, чем связь внутримолекулярная, но довольно могущественная, чтоб задерживать рядом примыкающие молекулы воды. Любая молекула может сразу создавать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28′, направленных к верхушкам тетраэдра, которые не позволяют при замерзании создавать плотную структуру. При всем этом в структурах льда I, Ic, VII и VIII этот тетраэдр верный. В структурах льда II, III, V и VI тетраэдры приметно искажены. В структурах льда VI, VII и VIII можно выделить 2 взаимоперекрещивающиеся системы водородных связей. Этот невидимый каркас из водородных связей располагает молекулы в виде сетчатой сетки, по структуре напоминающей соты с полыми каналами. Если лед подогреть, сетчатая структура разрушится: молекулы воды начинают проваливаться в пустоты сетки, приводя к более плотной структуре воды, — потому вода тяжелее льда.
Лед, который появляется при атмосферном давлении и плавится при 0 °С, — самое обычное, но всё же до конца не понятное вещество. Почти все в его структуре и свойствах смотрится особенно. В узлах кристаллической решетки льда атомы кислорода выстроены упорядоченно, образуя правильные шестиугольники, а атомы водорода занимают самые различные положения повдоль связей. Потому вероятны 6 эквивалентных ориентаций молекул воды относительно их соседей. Часть из их исключается, так как нахождение сразу 2 протонов на одной водородной связи маловероятно, но остаётся достаточная неопределённость в ориентации молекул воды. Такое поведение атомов необычно, так как в жестком веществе все подчиняются одному закону: или все атомы размещены упорядоченно, тогда и это — кристалл, или случаем, тогда и это — бесформенное вещество. Такая необыкновенная структура может реализоваться в большинстве модификаций льда — I, III, V, VI и VII (и по-видимому в Ic), а в структуре льда II, VIII и IX молекулы воды ориентационно упорядочены. По выражению Дж. Бернала лёд кристалличен в отношении атомов кислорода и стеклообразен в отношении атомов водорода.
Другая увлекательная разновидность льда – лёд II. Размещен лёд II на диаграмме состояния меж льдом III и льдом IX. Они различаются меж собой упорядочением протонов, кислородный же каркас у них схож: спирали из одних молекул воды, будто бы нанизанные на оси из других молекул воды. Когда же вероятности протона занять то или иное место равны, лёд будет неупорядоченным.
Лёд II состоит из полых колонок, образованных шестизвенными гофрированными циклами. Любая колонка окружена шестью такими же колонками, сдвинутыми друг относительно друга на треть периода. Структуру этого льда можно получить, если часть сот льда Ih развалить и превратить их в ажурные каркасы, связывающие другие соты. При этом размер получившихся шестигранных каналов очень увеличивается — конкретно у льда II самые широкие каналы, их диаметр составляет 3 A. В таких каналах могут размещаться атомы гелия, неона и даже молекулы водорода.
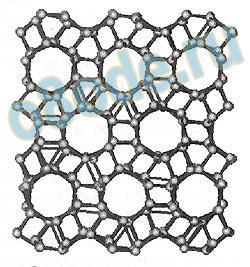
Рис. Структура льда II
Лёд III и V-й модификации долгое время сохраняются при атмосферном давлении, если температура не превосходит —170°С. При нагревании примерно до —150°С лёд преобразуются в кубический лёд Ic.
При конденсации паров воды на более прохладной подложке появляется бесформенный лёд. Эта форма льда может самопроизвольно перебегать в гексагональный лёд, причём тем резвее, чем выше температура.
Лёд IV-й модификации является метастабильной фазой льда. Он появляется еще легче и в особенности стабилен, если давлению подвергается тяжёлая вода.
Кривая плавления льда V и VII изучена до давления 20 Гн/м2 (200 тыс. кгс/см2). При всем этом давлении лёд VII плавится при температуре 400°С.
Лёд VIII является низкотемпературной упорядоченной формой льда VII.
Лёд IX — метастабильная фаза, возникающая при переохлаждении льда III и по существу представляющая собой его низкотемпературную форму.
Две самых последние модификации льда — XIII и XIV — открыли ученые из Оксфорда совершенно не так давно, в 2006 году. Предположение о том, что должны существовать кристаллы льда с моноклинной и ромбической решетками, было тяжело подтвердить: вязкость воды при температуре –160°С очень высока, и собраться совместно молекулам незапятанной переохлажденной воды в таком количестве, чтоб образовался эмбрион кристалла, тяжело. Этого удалось достигнуть при помощи катализатора — соляной кислоты, которая повысила подвижность молекул воды при низких температурах. В земной природе подобные модификации льда создаваться не могут, но они могут встречаться на замерзших спутниках других планет.
Но, все опыты с экзотичными метастабильными льдами, обычно, связаны с их охлаждением до температур сухого льда, водянистого азота, а то и гелия, а также со сжатием до давления в тысячи атмосфер. Общее представление о результатах можно получить, смотря на рисунок, где показана диаграмма состояния кристаллических льдов.
Рис. Диаграмма состояния кристаллических льдов
Не считая того, к модификациям кристаллической воды следует отнести и структурированную перехлаждённую воду и воду, получаемую в лабораторных критериях в виде твёрдого или вязкого стеклообразного продукта конденсации водяного пара на подложке при сверхнизких (100-150 K) температурах и так именуемую А-воду, владеющую плотностью около 2,1 г·см-3, обнаруженную в виде жидкокапельной фракции в природных облаках. А. Н. Невзоров упоминает и другие водянистые формы воды, не подпадающие под приведённое определение метастабильности (см. www.anevzorov.com/). Это “незамерзающая” вода, содержащаяся в био тканях, также “капиллярная” вода с плотностью около 1,4 г·см-3, сохраняющая жидкое состояние до -90°С даже в контакте с кристаллическим льдом. Все эти аномальные модификации воды были открыты сравнимо не так давно и представляют большой научный энтузиазм для исследования.
Более тщательно о метастабильной воде читайте веб-сайт кандидата физико-математических наук А. Н. Невзорова: www.anevzorov.com/.
К.х.н. О. В. Мосин
Литература:
-
Скрипов В.П., Коверда В.П. Спонтанная кристаллизация переохлаждённых жидкостей. – М.: Наука, 1984. – 231 с.
-
Вода и водные смеси при температурах ниже 0°С / Пер. с англ. Под ред. Ф. Франкса. – Киев: Наукова думка, 1985. – 388 с.
-
Невзоров А.Н. Исследования по физике водянистой фазы в льдосодержащих облаках // Метеорология и гидрология. – 1993. – № 1. – С. 55–68.
-
Nevzorov A.N. Cloud phase composition and phase evolution as deduced from experimental evidence and physicochemical concepts. – 13th Int. Conf. on Clouds and Precipitation, Reno, Nevada, USA, 2000, 728–731. 5. Невзоров А.Н. Из чего состоят облака // Химия и жизнь. – 2006. – № 10. – С. 41–45.
-
Невзоров А.Н. Биморфизм и характеристики жидкокапельной воды в прохладных облаках // Вопросы физики туч. – М.: Метеорология и гидрология, 2008. – С. 268–298.
-
Невзоров А.Н. О внутреннем механизме кристаллизации метастабильной водянистой воды и об его эффектах, влияющих на внутриоблачные процессы // Изв. АН РАН Физ. Атм. и Океана. – 2006. – Т. 42. – № 6. – С. 830–838. / Nevzorov A.N. Internal Mechanism of Metastable Liquid Water Crystallization and Its Effects on Intracloud Processes. Izvestiya, Atm. and Ocean Phys., 2006, vol. 42, № 6, 765–772.
-
Nevzorov A.N. Some properties of metastable states of water. Physics of Wave Phenomena, 2006, № 1, с. 45–57.