 Нанотехнологии: углерод, водород, бензол
Нанотехнологии: углерод, водород, бензол
Евгений Александрович АНДРЮШИН
Сила нанотехнологий: наука&бизнес
ГЛАВА 4. Использовать связи
Обоюдная привлекательность
Нанотехнологу недостаточно знать, как устроена наноструктура в ее ставшем либо застывшем состоянии. Такие определения даже плохо применимы к наноструктурам. Нужно осознавать, как они преобразуются. Более всераспространенный пример такового преобразования — хим реакция. Сначала мы имеем одну совокупа атомов и молекул, на выходе получаем совсем другую. Перевоплощение одних молекул в другие, обычно, связано с преодолением потенциального (квантового) барьера. Наличие этого барьера обосновано тем, что любая молекула (также, атом, ион, и т. п.) представляет собой энергетически более либо наименее устойчивое образование. Перестройка реагирующих сущностей просит разрыва либо ослабления имеющихся хим связей, на что нужно затратить энергию. Что, фактически, принуждает атомы соединяться вместе в молекулы и в кристаллы? Сначала, это электронные силы — атомы состоят из зарядов, которые взаимно притягиваются и отталкиваются друг от друга. При достаточном приближении 2-ух атомов начинается обоюдное воздействие их зарядов и устойчивая конфигурация меняется.
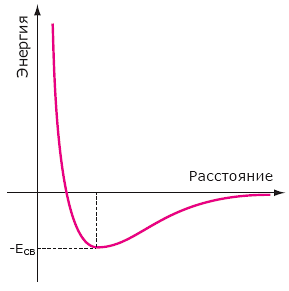
Рис. 4.1. Условная зависимость энергии 2-ух атомов от расстояния меж ними. Минимум кривой отвечает образованию двухатомной молекулы. Величина Есв именуется энергией связи двухатомной молекулы.
Идеальнее всего чуток подробнее поглядеть на простейшую молекулу водорода Н2. Два положительно заряженных протона, два негативно заряженных электрона, меньше не бывает. Но молекулу нельзя рассматривать, как электростатическую систему зарядов. Можно условно сказать, что при ее образовании квантовые законы играют огромную роль, чем фактически силы электронные. Если разглядеть процесс образования молекулы Н2, как процесс сближения атомов водорода, то в этом процессе происходит квантовое обобществление электронов, начинается обмен электронами меж атомами. Можно высчитать зависимость энергии системы 2-ух атомов Н зависимо от расстояния меж протонами (рис. 4.1). Энергия 2-ух независящих атомов принята за 0. Тогда при сближении энергия будет уменьшаться, что соответствует притяжению атомов, потом, на малых расстояниях, энергия системы резко возрастает, атомы отталкиваются1. Минимум кривой на рис. 4.1 соответствует более устойчивому состоянию с малой энергией. Выигрыш в энергии именуется энергией связи, если его нет, то и не возникнет соответственная молекула.
В процессе приближенного расчета энергии связи молекулы водорода, при котором начальным состоянием выбраны два независящих атома водорода, можно выделить разные вклады в энергию связи: кулоновский, обменный, от перекрытия электрических туч. Основным вкладом оказывается обменный, возникающий в итоге того, что электрон первого атома некую часть времени проводит поблизости второго атома, а электрон второго атома некую часть времени проводит поблизости первого. Это итог квантового нрава образования молекулярных связей.
Вобщем, выделение обменного вклада в энергии связи не стоит осознавать практически. Это только наша интерпретация квантово-механических процессов, попытка сделать их более приятными. Упомянутый расчет довольно грубо отвечает опытным данным, если его облагораживать, добиваться более четкого соответствия экспериментальным данным и брать другое начальное состояние для расчета, то никакого разделения на кулоновскую и обменную энергию 2-ух невзаимодействующих атомов не появляется. Объединение атомов — чисто квантовый процесс, в процессе которого появляется новенькая система уровней энергии, характеризующая молекулу (либо кристалл в целом) и напоминающая начальную систему уровней невзаимодействующих атомов менее чем малыши напоминают родителей. Каждому уровню энергии соответствует стоячая электрическая волна, электрон колеблется вокруг и около атомов и образует вроде бы скопление электрической плотности. Строго говоря, плотность этого облака указывает возможность обнаружения электрона в той либо другой области места либо долю времени, которую электрон проводит в той либо другой области. Такие облака электрической плотности просто высчитать для атома водорода — они изображены на рис. 4.2. Видно, что ни одно из этих туч даже близко не припоминает планетарную модель движения корпускулы вокруг центрального светила.
Рис. 4.2. Условное изображение туч электрической плотности для различных состояний электрона в атоме водорода. Эти состояния обозначаются квантовыми числами, а конкретно основным квантовым числом n, которое определяет общий размер облака; орбитальным квантовым числом l и магнитным квантовым числом m, которые определяют форму облака, также спином, который на форму и размер облака никак не оказывает влияние и не имеет традиционного аналога. Спиновое состояние электрона может иметь два значения, которые условно обозначаются в предстоящем стрелками, направленными ввысь и вниз. Число l всегда меньше n, облака с различным l имеют буквенное обозначение s, p, d, f. Конкретно различия в форме электрических туч для этих состояний очень существенны при образовании связей меж атомами.
И конкретно нрав этих туч определяет хим связь атомов. Обычно выделяют последующие главные виды связи: ионная, ковалентная и слабенькие связи (водородные, координационные, ван-дер-ваальсовы)2. Молвят также о степени полярности связи, т. е. о заряде, который приобретает либо теряет один атом в итоге связывания с другим. Как раз ионная связь является последним случаем полярности связи. В данном случае считается, что электрон покидает один атом и перебегает на другой (чего по сути стопроцентно не происходит никогда). Броским примером таковой связи является поваренная соль — NaCl. Как молекулу NaCl, так и кристалл NaCl (рис. 4.3) можно рассматривать как объединение ионов Na+ и Cl—.
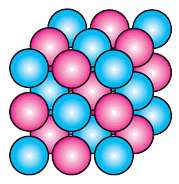
Рис. 4.3. Условное изображение кристаллической решетки NaCl — красноватые и голубые шарики соответствуют ионам Na+ и Cl-.
Но эта книга не учебник и на точность не претендует, позволю для себя дать только условное описание связи. Почти всегда хим связь 2-ух атомов представляет собой обобществление 2-ух электронов, по одному от каждого из 2-ух взаимодействующих атомов. Связь тем посильнее, чем больше перекрытие начальных электрических туч. Электрические облака перераспределяются так, что их плотность меж соединяющимися атомами возрастает. Если б в молекуле существовали только сферически симметричные потенциальные ямы вокруг ядер, то устойчивая многоатомная система просто не могла бы образоваться. Конкретно формирование новых возможных ям в пространстве меж ядрами за счет деяния различных ядер приводит к перераспределению электрической плотности и связыванию атомов в молекулы.
Каждой хим связи 2-ух атомов может быть сопоставлена кривая вида рис. 4.1 и соответственная энергия связи. Для начала разглядим это как парный процесс. Для хим связи 2-ух атомов необходимо два электрона, по одному от каждого атома. В хим связи участвуют только наружные электроны — те, чьи облака электрической плотности выходят на границу атома. Такие электроны именуются валентными. Фактически валентностью принято именовать способность атомов к образованию хим связей. Принято определять валентность числом электронов атома, которые образуют связи, формирующие молекулу. Развитие представлений о валентности практически начато английским физиком (либо химиком?) Джоном Дальтоном, который в 1804 году предложил закон кратных отношений.
Многоэлектронные атомы способны образовать несколько связей, которые в первом приближении могут считаться независящими. Грубо можно высчитать энергию связи многоатомной молекулы как сумму энергий хим связей меж парами ее атомов — меж теми атомами, которые объединены парами обобществленных электронов. По сути нрав хим связи одной и той же пары атомов в различных молекулах различается — на нее оказывают влияние другие атомы молекулы.
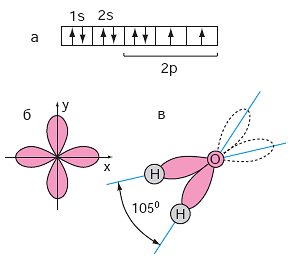
Рис. 4.4. Кислород и вода:
(а) — электрическая конфигурация атома кислорода О, всего у него 8 электронов, в согласовании с обозначениями атомной физики два 1s-электрона, два 2s-электрона и четыре р-электрона. Стрелки обозначают спиновое состояние электронов;
(б) — облака электрической плотности р-электронов кислорода.
(в) — условное изображение молекулы воды.
Несколько слов в качестве примера о молекуле воды. На рис. 4.4 изображена электрическая конфигурация атома кислорода, в какой есть sи р-электроны (различие вида их электрических туч см. на рис. 4.2). В молекуле воды Н2О атом кислорода О образует две хим связи с 2-мя атомами водорода Н. В их участвуют два р-электрона кислорода и единственные s-электроны атомов водорода. В свободном состоянии оси туч р-электронов образуют угол 90 градусов. В молекуле воды они расползаются на угол 105 градусов. В похожей по конфигурации молекуле сероводорода Н2S связи с водородом образуют угол 92 градуса. Так что все хим связи довольно персональны, относительно маленькие конфигурации квантовых характеристик, размеров атомов и иных геометрических черт приводят к разительному различию параметров.
Углерод
Из всех соединений хим частей более 95% — соединения углерода, и только наименее 5% — соединения всех иных хим частей. Соединениям углерода выделена отдельная наука — органическая химия, при этом это даже не химия 1-го элемента, а химия неких классов соединений этого элемента. Предпосылкой тому всего два-три соотношения квантовых характеристик. Углерод находится ровно посреди второго периода таблицы Менделеева и более склонен создавать неполярные связи в отличие от собственных соседей справа и слева (полярность связей возрастает при переходе от четвертой группы к первой либо седьмой). Углерод — 1-ый элемент четвертой группы таблицы Менделеева. Его заряд и, соответственно, количество электронов — 6, тогда как у последующего элемента той же группы, кремния — четырнадцать. Радиус атома углерода 0,07 нм, в том время как радиус атома кремния 0,11 нм, на 57% больше3.
При образовании хим связи атомы углерода могут подойти поближе друг к другу, чем, скажем, атомы кремния. Хим связь атомов С–С оказывается очень крепкой (в среднем на несколько 10-ов процентов больше, чем связь атомов Si–Si). Представление о прочности связи С–С дает алмаз — самый крепкий природный материал, состоящий только из атомов углерода. Значимая крепкость связей делает вероятным образование длинноватых цепей соединенных меж собой углеродных атомов. Уникальность углерода обоснована в значимой степени тем обстоятельством, что образуемые им С–С связи высокопрочны и в тех случаях, когда атомы углерода сразу связаны с другими элементами.
Сразу с этим энергия связи кремния с кислородом на 28% выше, чем энергия связи углерода с кислородом. Подобные соотношения квантовых характеристик обуславливают то, что вокруг мы лицезреем нескончаемое обилие соединений углерода, образующее базу жизни, а основная форма существования кремния — мертвенный песок SiO2.
Изложенные происшествия разъясняют значимость углерода для нанотехнолога. Это 2-ой краеугольный камень для его манипуляций после полупроводниковых материалов. По-видимому, большая часть нанотехнологических устройств и большая часть создаваемых материалов будут содержать углеродные скелеты и/либо оболочки подобно тому, как углеродные структуры являются основой всех био образований.
На рис. 4.5 изображена электрическая конфигурация невзаимодействующего атома углерода. Но при хим взаимодействиях он смотрится совсем по-другому: при образовании связей нередко происходит тетраэдрическое перестроение электрических туч на базе так именуемой s-p гибридизации — такое изменение формы электрического облака показано на рис. 4.5(в). Четыре валентных электрона углерода в данном случае образуют облака вида рис. 4.5(г). Первым предложил тетраэдрическую модель атома углерода голландский химик Якоб Хендрик Вант-Гофф в работе 1874 года Химия в пространстве.
Рис. 4.5. Углерод: (а) электрическая конфигурация атома углерода С, всего 6 электронов, в согласовании с обозначениями атомной физики два 1s-электрона, два 2s-электрона и два 2р-электрона. Но в связанном состоянии углерода в большинстве молекул энергетически выгоден переход атома углерода в четырехвалентное состояние. Выигрыш в энергии хим связей больше, чем энергозатрата на возбуждение электрона 2s > 2p. Тогда настоящее валентное состояние углерода изображается диаграммой (б), условная схема sp3 гибридизации показана на рис (в), а вид электрических туч валентных электронов углерода в тетраэдрической конфигурации изображается рисунком (г).
Связи атомов углерода еще богаче, никак не всегда электрические облака имеют тетраэдрическую конфигурацию, но конкретно в данном случае появляется самое жесткое известное в природе вещество — алмаз (рис. 4.6), в каком каждый атом углерода окружен 4-мя другими атомами углерода, находящимися в углах тетраэдра. В данном случае оси перекрывающихся электрических туч р-электронов совпадают, что дает очень крепкую конструкцию (во всяком случае, до сего времени никто из нанотехнологов ничего более крепкого сделать не сумел).

Рис. 4.6. Кристалл алмаза.
Анализ геометрии туч электрической плотности — одна из главных задач нанотехнолога4. К счастью, определяющим эту геометрию является поведение наружных, валентных электронов. Состояние внутренних оболочек атомов слабо находится в зависимости от того, есть ли вокруг другие атомы, чем поближе электрон к ядру, тем меньше ощущается воздействие примыкающих атомов. Атомы, если так можно выразиться, остаются самими собою и в составе молекулы.
Для наружных же, валентных электронов взаимодействие со своим ядром сопоставимо с воздействием ядра примыкающего атома. Изменение конфигурации зарядов делает новые потенциальные ямы в пространстве меж атомами, куда перетекает электрическая плотность при образовании молекул. Таким макаром, валентная связь и состоит в образовании таковой возможной ямы. Это более четкий образ,чем представление о ковалентной связи, как о спаривании электронов. Если б для ковалентной связи были необходимы конкретно два электрона, то не мог бы существовать молекулярный ион водорода Н2–, который есть связанное состояние 2-ух протонов и всего 1-го электрона!
Но вернемся все-же к способностям, которые открывают электроны углерода перед нанотехнологом.
Бензол
Один из очень развитых методов представить структуру молекулы — написать ее структурную формулу. Точки, отвечающие химически связанным атомам, принято соединять отрезками (валентными штрихами), символизирующими хим связи меж надлежащими парами атомов. Пример таковой формулы для молекулы метана СН4 см. на рис. 4.7. Каждый штришок значит образованную парой электронов валентную связь. Молекула метана имеет в пространстве тетраэдрическую форму — атом углерода находится в центре, а атомы водорода — в верхушках правильного четырехгранника. Нарисованные на бумаге структурные формулы, естественно, не могут практически отразить трехмерную структуру, но этот язык очень полезен и отражает очень многие характеристики молекул. Более того, чем далее, тем паче разумеется, что практически все характеристики молекул и веществ по сути структурные!
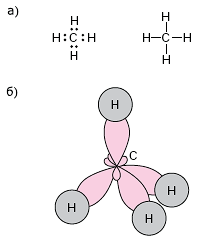
Рис. 4.7. Метан:
(а) структурная формула метана СН4;
(б) пространственная структура молекулы метана.
Современное осознание структуры молекул начало формироваться во 2-ой половине XIX века. Очень полезно вспомнить историю открытия структуры бензола. В XIX веке осознание пространственной структуры молекулы С6Н6 вызывало значимые затруднения. Было тяжело представить, как 6 четырехвалентных атомов углерода присоединяют всего 6 одновалентных атомов водорода. Правильную структуру выдумал германский химик-органик Фридрих Август Кекуле фон Штрадониц. В 1866 году Кекуле предложил свою известную формулу бензола — кольцо из 6 атомов углерода (рис. 4.8а). Каждый атом углерода в нем связан 3-мя валентностями с 2-мя примыкающими атомами углерода, а 4-ая валентность употребляется для связи с водородом. Атом водорода может быть заменен при реакции на какой-нибудь другой атом либо радикал. Открытие принципа построения бензольного кольца сделало вероятным разъяснение структур многих соединений углерода и отдало мощнейший импульс развитию хим синтеза, в том числе в индустрии. История открытия Кекуле описана неоднократно, при всем этом сам Кекуле в различных случаях описывал ее по-разному: в одном из описаний он повествует, как писал книжку по химии и задремал, повернувшись к камину. Образы атомов и молекул заплясали в его воображении. Мое интеллектуальное око, вкусившее вкус в видениях подобного рода, различало сейчас более большие образования… Длинноватые цепочки, все в движении, нередко сближаются вместе, извиваясь и дергаясь, как змеи!.. Одна из змей ухватила собственный свой хвост, и фигура эта саркастически закружилась перед моими очами. Пробужденный вроде бы вспышкой молнии, я провел остаток ночи, детально разрабатывая следствия новейшей догадки. В другом случае он пишет так: В один прекрасный момент вечерком, будучи в Лондоне, я посиживал в омнибусе и раздумывал, как изобразить формулу бензола C6H6 в виде структурной формулы… В это время я увидел клеточку с мортышками, которые ловили друг дружку, то схватываясь меж собою, то снова расцепляясь, и один раз схватились так, что образовали кольцо. Любая одной задней лапой держалась за клеточку, а последующая держалась за другую ее заднюю лапу обеими фронтальными, хвостами же они забавно размахивали по воздуху… 5 обезьян составили круг, и у меня сразу блеснула идея: вот изображение бензола! Из этих 2-ух описаний потомки избрали змею, кусающую себя за хвост.
Рис. 4.8. Бензол:
а) Структурная формула бензола С6Н6, предложенная Кекуле;
б) структурная формула бензола, отражающая равенство валентных связей меж атомами углерода в бензоле;
в) структурная формула неорганического бензола B3N3H6.
Но в формуле Кекуле есть недостаток — в молекуле бензола нет чередующихся одинарных и двойных связей меж атомами углерода в кольце. Все связи С–С равноправны, и лучше изображать ее формулой рис. 4.8 б. В молекуле бензола появляется единое кольцевое электрическое скопление, может быть даже наблюдение его токовых состояний, т. е. движения электронов повдоль кольца. Электроны в бензоле делокализованы — размазаны по всей молекуле. Этот эффект имеет полностью определенное числовое выражение: энергия связи реальной молекулы бензола на 1,5 эВ больше, чем у ее модели, структура которой соответствует формуле Кекуле, т. е. с 3-мя двойными и 3-мя ординарными связями.
Если строго следовать валентной схеме и осознавать ее формально, мы будем обязаны приписывать связям схожих атомов в различных молекулах однообразные характеристики. В то же время все достояние соединений органической химии наглядно указывает, что даже связи атомов углерода С–С различны по своим свойствам в различных молекулах. Напротив, схожее строение электрических туч различных молекул приводит к похожести хим параметров. Броский, хотя и в главном теоретический пример — молекула неорганического бензола B3N3Н6 (рис. 4.8 в). По хим свойствам она очень припоминает фактически бензол.
Рис. 4.9. Электрическая плотность в плоскости молекулы бензола.
Если поглядеть лишь на ядра бензольного кольца, то каждое из их должно испытывать силу отталкивания со стороны других. Восполнить эту силу может только притяжение со стороны электронов. Вправду, скопление электрической плотности смещено вовнутрь бензольного кольца (рис. 4.9). Рассредотачивание электрической валентной плотности имеет соответствующую для ковалентной связи особенность: в пространстве меж ядрами сосредоточен симметрично расположенный сгусток электрического облака. В повторяющихся и каркасных молекулярных структурах вместе с ближними (локализованными) взаимодействиями распределенная снутри кольца либо полиэдра часть электрического облака молекулы выступает как общая связывающая сила для многих ядер молекулы. Другими словами, в неких системах — бензол относится к числу первых исследованных таких систем — кроме локализованных связей можно выделить еще распределенные, которые нельзя представить как сумму локализованных.
Конкретно образование одного облака электрической плотности молекулы, не сводящегося к парным перекрытиям, оказывается более энергетически прибыльным. Делокализация электронов в больших молекулах подобна образованию энергетических зон кристаллов и открывает очень принципиальные перспективы для нанотехнологов, конструирующих наноструктуры для выполнения тех либо других функций.
Фуллерены
Углерод для нанотехнолога более принципиальный конструкционный материал, чем сталь для строителей более масштабных конструкций. В природе давно были известны две модификации5 углерода: алмаз (рис. 4.10 а) и графит (рис. 4.10 б). Тяжело отыскать что-либо общее в этих 2-ух субстанциях, кроме того, что они составлены из схожих атомов.
Но оказалось, что это еще не все. В 1968 году была открыта6 еще одна модификация углерода — карбин (рис. 4.10 в). Различие всех 3-х определяется только различием геометрии туч валентных электронов. Алмаз можно считать трехмерной формой углерода, хим связи прочно сшивают вещество во всех направлениях. Графит — квазидвумерная форма, атомы углерода образуют набросок шестиугольных сот в плоскости, каждый шестиугольник — аналог молекулы бензола. Расстояние меж плоскостями в два с излишним раза больше, чем расстояние меж атомами в плоскости, плоскости связаны меж собой слабенькими ван-дер-ваальсовыми силами. Стоит увидеть, что расстояние меж атомами углерода в плоскости графита (0,142 нм) меньше, чем расстояние меж атомами углерода в алмазе (0,154 нм), и хим связь в плоскости графита посильнее, чем в алмазе! Карбин — квазиодномерная форма углерода, это линейные полимерные цепочки, состоящие только из атомов углерода. Цепочки довольно слабо связаны вместе.
Рис. 4.10. Кристаллические модификации углерода:
(а) кристаллическая решетка алмаза;
(б) кристаллическая решетка графита;
(в) кристаллическая решетка карбина.
В этих 3-х формах реализуются все три типа хим связи, которые характерны углероду. Но перечень аллотропных модификаций углерода был продолжен открытием фуллеренов. Это класс веществ, в каких атомы углерода объединены в молекулы, любая из которых насчитывает 10-ки атомов. Устойчивыми являются молекулы С60, С70, С74, С76, С84 , С164, С192, С216…(есть также полустабильные молекулы фуллеренов). Модель молекулы С60 изображена на рис. 4.11 и зрительно воспроизводит футбольный мяч. Математическое заглавие фигуры — усеченный икосаэдр, в конструкции 60 вершин, которые занимают атомы углерода, 20 шестиугольных и 12 пятиугольных граней.
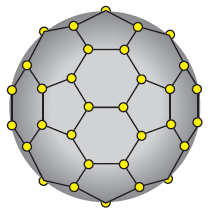
Рис. 4.11. Модель молекулы фуллерена С60.
Открытие состоялось в 1985 году в опытах по низкотемпературной масс-спектрометрии паров графита, образующихся после лазерного облучения кристаллического графита. Были обнаружены насыщенные пики диапазона, надлежащие кластерам с массой в 60 и 70 атомов углерода. История о том, как удалось показать, что С60 — это сферическая молекула, очень припоминает историю об открытии структуры бензола Кекуле. Вот что писал доктор Смолли (один из создателей открытия): В один прекрасный момент ночкой я пробудился от жажды, достал из холодильника банку пива и продолжал размышлять о структуре нашего кластера. Вдруг я вспомнил, как Гарри Крото (другой из создателей) говорил о смешном детском конструкторе, при помощи которого он смастерил для собственных малышей геодезический купол из шестиугольников и пятиугольников. Я здесь же порезал фигуры из плотной бумаги и практически сходу собрал из их половинку сферы. Когда я приладил вторую половинку к первой, сердечко мое екнуло…
Роберт Кёрл, Рихард Смолли (США) и Харолд Крото (Англия) были удостоены Нобелевской премии по химии в 1996 году за открытие фуллеренов. Молекула С60 была наречена создателями бакминстерфуллерен в честь южноамериканского конструктора Ричарда Букминстера Фуллера, проекты которого умопомрачительно напоминают углеродные каркасы (рис. 4.12). Фуллер высказал, запатентовал и в собственных проектах воплотил идею сотворения конструкций сферической формы из многоугольников. Сейчас весь класс этих веществ именуется фуллерены, имя молекулы С60 стремительно сократилось до букибол, молекулярные кристаллы из молекул фуллеренов именуются фуллериты.

Рис. 4.12. Купол, спроектированный южноамериканским архитектором Букминстером Фуллером для Глобальной выставки в Монреале в 1967 году.
Фуллерены владеют очень любопытными качествами, которые не могут не быть применены нанотехнологами. Более подробное их описание интересующиеся просто отыщут в литературе, некие ссылки приведены в конце книжки. Тут стоит упомянуть только о прекрасной стойкости — для равной относительной деформации к фуллерену нужно приложить вдвое огромную силу, чем к алмазу. Это, естественно, теоретическая оценка, но она позволяет возлагать на создание материалов более крепких, чем алмаз. Увлекательна также низкая растворимость в органических растворителях, нелинейные оптические характеристики и особенно сильные (для углерода) окислительные характеристики. Есть также заманчивая химия внутренности молекулы фуллерена. Радиус молекулы С60 составляет 0,35 нм, вовнутрь может много чего поместиться! К истинному времени во внутреннюю полость молекул фуллеренов научились помещать уже несколько 10-ов разных атомов. Надлежащие структуры именуются эндоэдральными, скажем, атом лантана снутри фуллерена обозначается La@C60, а присоединение такого же атома снаружи — LaC60.
Может быть, что не так много конструкций будут использовать саму молекулу фуллерена, но, в силу собственной красы она стала эмблемой современного развития нанотехнологии. Фуллерен С60 принадлежит к тем редчайшим хим структурам, которые владеют наивысшей точечной симметрией. Из Нобелевской лекции Г. Крото: История открытия С60 не может быть верно оценена без учета красы формы этой молекулы, которая обоснована ее неописуемой симметрией. Другой принципиальный нюанс, создающий ауру вокруг этой молекулы, связан с ее заглавием, которое вызывает ассоциацию с геодезическими куполами, сделанными Бакминстером Фуллером7. Все это присваивает нашей стильной молекуле харизму, которая обворожила ученых, привела в экстаз обывателей, добавила интереса юным в их отношении к науке и, а именно, придала свежее дыхание химии…
К истинному времени уже понятно, что простый углерод способен создавать сложные вогнутые поверхности, состоящие из пяти-, шести-, семии восьмиугольников. Пятиугольники сформировывают положительное искривление плоскости шестиугольников (купол), а семиугольники и восьмиугольники — отрицательное (внутренняя сторона бублика). Уже получены огромные фуллерены (рис. 4.13) и слоистые структуры, напоминающие луковку либо капусту, цилиндрические, тороидальные и спиральные углеродные структуры. По-видимому, неподалеку то время, когда геометрию углеродной структуры будут делать на заказ, а на конференциях будут показывать более престижные формы сезона.
Рис. 4.13. Модель молекулы С560.
Такие построения только кажутся ублажение любопытства. Даже маленькие различия в форме и расстоянии меж атомами в наноструктуре манят очень значимые конфигурации параметров. Кривизна поверхности сферы фуллерена приводит к тому, что надлежащие формы туч электрической плотности отличаются очень очень (рис. 4.14), что и обуславливает совсем разную химию и физику соединений.
Рис. 4.14. Условное изображение валентной электрической плотности вокруг молекулы бензола (а) и практически аналогичного кольца из 6 атомов углерода, входящего в состав молекулы фуллерена (б).
Рис. 4.15. Структуры углеродных нанотрубок.
Кружочки изображают углерод, а черточки соединяют атомы в соответствующие шестиугольники (не считая округленных концов трубки, где есть и пятиугольники), можно считать, что однослойная трубка запирается половинкой фуллерена).
(а) структура, которая именуется зигзагной,
(б) структура, которая именуется кресельной,
(в) структура, в какой шестиугольники образуют навитые на цилиндр спирали.
Из всех исследуемых в ближайшее время углеродных структур стоит выделить так именуемые углеродные нанотрубки, которые зрительно можно представить, как свернутые в цилиндры участки графитовых плоскостей (рис. 4.15). Это, естественно, схожие фуллеренам структуры, их поиск был стимулирован открытием фуллеренов, в первый раз их изображения были получены в 1991 году Сумио Ииджимой (Япония) при помощи электрического микроскопа. Микрофотография приведена на рис. 4.16.
Рис. 4.16. Приобретенное при помощи просвечивающего электрического микроскопа изображение содержащей нанотрубки катодной сажи. Видны также фуллереноподобные большие образования и бесформенный углерод. Отрезок понизу рисунка соответствует масштабу 10 нм.
Нанотрубки — вытянутые структуры, состоящие в главном из шестичленных колец углерода8. Они могут быть как открытыми, так и закрытыми — закрытый конец формируется аналогично полусфере фуллерена за счет введения 6 пятиугольников. Углеродные нанотрубки могут быть однои мультислойными, при всем этом размещение шестиугольников углерода на стенах может быть разным. Стоит увидеть, что в 90-х годах XX века, уже после сообщения Ииджимы и вербования всеобщего внимания, стало ясно, что нанотрубки уже не один раз были получены в разных опытах (в том числе фото нанотрубки оказалось в статье Ииджимы 1980 года!). Но до начала 90-х годов они никому не были необходимы и поэтому были незамечены. И только нанотехнологический бум заинтересовал к этим структурам.
Углеродные нанотрубки могут владеть как металлическими, так и полупроводниковыми качествами. Это находится в зависимости от метода сворачивания (рис. 4.17) графитовой плоскости в цилиндр, также от поперечника нанотрубки (при увеличении поперечника происходит переход от полупроводниковых к железным состояниям). Таким макаром, углеродные нанотрубки могут (зависимо от нрава электрических состояний) служить одномерными проводниками либо природными квантовыми проволоками.
Уже сама конструкция нанотрубки дает подсказку, что стоит испытать использовать ее механические свойства — расчетный модуль сжатия повдоль оси трубки раз в 10 превосходит соответственный показатель стали. Очень заманчивым является внедрение внутреннего места трубок — внедрение туда атомов металла позволяет получить огромное обилие электронных параметров. В конце концов, это природные хранилища, скажем, для чего-либо ненадобного. Нанотрубки владеют значимой эмиссионной способностью — под действием электронного поля их концы просто испускают электроны. Исследуется возможность использования нанотрубок в качестве зондов для сканирующих микроскопов.
Рис. 4.17. Сетка шестиугольников условно изображает плоскость атомов углерода в графите, атомы занимают позиции в узлах сетки. Углеродные нанотрубки в реальности не образуются методом сворачивания графитовых плоскостей. Но структуру нанотрубок комфортно учить, рассматривая мысленные методы сворачивания графитового листа в цилиндр. На рисунке вектором Т показано одно из вероятных направлений сворачивания, получившуюся структуру трубки именуют кресельной, ей соответствует железный нрав электрических состояний получившейся трубки. При сворачивании в других направлениях электрические состояния имеют полупроводниковый нрав, появляется щель.
Из нанотрубок можно конструировать макромолекулярные объекты с размерами до сотен нанометров и уподоблять эти объекты действующим биологическим структурам. В заключение лаконичного описания углеродных конструкций стоит направить внимание на то, что конструкции трубок встречаются и посреди био объектов.
Женское начало в химии
Прогресс в разработке новых веществ и структур за последние 50 лет (2-ая половина XX века) очень значителен. Необходимо отметить прекрасные заслуги в рамках таких технологических процессов, как молекулярно-лучевая эпитаксия (схема эпитаксиального послойного роста структур см. на рис 2.19), литография для получения подходящего структурного рисунка, хим синтез. Фактически, эти заслуги и стали основой нанотехнологического бума, который начался в 90-х годах XX века и развернулся сначала века XXI. Но, невзирая на всё это, мы, быстрее, находимся на стадии рассмотрения открывающихся способностей.
Сегодняшние прекрасные результаты нанотехнологов по сопоставлению с тем, что будет реализовано в течение нескольких 10-ов лет в дальнейшем, представляются как 1-ые постройки из бревен и камня по сопоставлению с высотными зданиями из стали, стекла и бетона. То, что пока мы умеем делать — это грубое соединение простых частей, назовем это грубой мужской работой. Имеющиеся технологии сотворения наноструктур, обычно, очень неспешные и энергозатратные. Да, при помощи современных туннельных микроскопов можно не только лишь следить структуры на наномасштабах, но время от времени устанавливать отдельные атомы в нужные позиции. Но собирать таким методом наноструктуры для практического использования навряд ли будет сколько-либо отлично.
Все нанотехнологи грезят о разработках самосборки наноструктур. Охото, чтоб после задания общих конструктивных принципов нужные структуры, материалы, устройства формировались без помощи других, без необходимости конкретного вмешательства технолога. До некой степени это принцип развития, реализуемый в программном обеспечении — юзер компьютера не пишет программки ab initio, не лазит в программные коды, для решения собственной задачки он запускает одним щелчком целые шлейфы программ, не задумываясь об их трудности. Другой пример: человек может съесть несколько ложек практически хоть какой органики и запустить каскад сложнейших технологически отлаженных реакций.
Для того чтоб такая мечта нанотехнолога осуществилась, необходимо чтоб работали не только лишь грубые структуры и каркасы. Нужно использовать в нанотехнологических операциях значительно более тонкое начало — слабенькие связи атомов, кроме их валентных связей. Слабенькие связи не приводят к образованию молекул либо к присоединению к молекуле дополнительного атома. Слабенькие связи инсталлируются меж атомами, принадлежащими к различным молекулам, либо меж атомами, принадлежащими к различным частям одной (но большой) молекулы, либо меж атомами, принадлежащими кристаллу, и атомами, близко подошедшими к его поверхности. Причина образования слабенькой связи или электронное взаимодействие (полярные связи могут по-разному заряжать различные части различных молекул, разноименно заряженные части могут слабо притягиваться), или перекрытие электрических туч. Образование слабенькой связи есть создание новейшей возможной ямы, как следует, конфигураций геометрии электрических туч, изменение структуры энергетических уровней и изменение диапазона фотонов, соответственных переходам меж этими уровнями.
Атомы в качестве строительного материала наноструктур отличаются от кирпичей и бетонных блоков. Из кирпичей можно выстроить произвольные объекты, можно ставить кирпичи туда, куда мы желаем, единственным ограничением является сила тяжести и крепкость самих кирпичей. Атомы же лучше сопоставить с созданиями, владеющими квантовой волей, выраженной троичным образом: закон Кулона, принцип Паули, уравнение Шредингера. Даже при помощи зонда микроскопа не получится поставить атом в произвольную позицию.
Более увлекателен случай так именуемой водородной связи : атом водорода очень небольшой, даже будучи связан в одной молекуле, просто подбирается к другим молекулам и образует относительно слабенькие перекрытия электрической плотности. Соответствующий спектр энергий водородной связи 0,01? 0,4 эВ, в то время как мощная хим связь дает приблизительно от 1 до 6 эВ, это разделение, вобщем, довольно условно.
Самым броским примером образования водородных связей является та же вода. Молекулы воды просто склеиваются вместе, условно это показано на рис. 4.18. Водородные связи не могут обеспечить правильную структуру, в воде образуются только кластеры молекул, которые потом распадаются, чтоб склеиться вновь в другой конфигурации. Схожая ассоциированность молекул воды вместе обеспечивает такие характеристики, как уменьшение летучести, повышение вязкости, увеличение температуры плавления и кипения. Другими словами, вода без водородных связей была бы значительно более водянистой и леденела бы при куда более низких температурах. Водородные связи обеспечивают и многие другие характеристики воды, обсуждение которых навряд ли имеет отношение к предмету этой книжки.
Рис. 4.18. Водородные связи в воде:
а) структурная формула кластеров воды;
б) розовыми шариками изображены атомы кислорода, а сероватыми — атомы водорода. Координация 2-ух молекул воды;
в) Более соответствующая для связывания молекул воды в кластеры тетраэдрическая координация.
Очередной пример сочетания разных типов связи атомов можно узреть на рис. 4.19 — это условное изображение растворенной в воде поваренной соли. Так что даже такие, казалось бы, обыкновенные вещи, как пресная и соленая вода, владеют собственной, довольно сложной внутренней структурой.
Водородные и остальные нековалентные связи делают те тонкие взаимодействия, которые обеспечивают способность к самоорганизации главных для процессов жизни молекул, также их способность распознавать другие частички и молекулы. Энергия каждой слабенькой связи в 10–100 раз меньше, чем энергия сильной хим связи; значительно воздействовать на структуру слабенькие связи могут только тогда, когда их много. Для определения молекул также нужно, чтоб слабеньких связей было много и чтоб они были различные. Конкретно на слабеньких связях основаны процессы переноса вещества в организмах — скажем, молекулу кислорода нужно перенести из легких человека к нуждающимся в энергии мускулам. Крепкое хим связывание кислорода потребовало бы значимых издержек энергии на оборотную восстановительную реакцию.
Рис. 4.19. Модель ионной пары Na+ и Cl– в аква растворе хлорида натрия, расстояния указаны в нанометрах. Ковалентная связь О–Н чуток слабее, чем в водянистой воде (там расстояние 0,096 нм). Энергия водородной связи 0,19 эВ, а энергия, нужная для разрыва связи натрия и хлора — 0,03 эВ.
В нашей макрожизни есть масса ситуаций, когда необходимы крепкие резьбовые, сварные и т. п. конструктивные соединения — но более нередко необходимы и мягенькие захваты пальцами. Подъемным краном кусочек хлеба ко рту не поднесешь.
Стоит направить внимание, что исходя из убеждений квантовой теории образование слабеньких связей идет через процесс туннелирования. Две независящие молекулы воды полностью устойчивы энергетически. Формирование водородной связи меж ними можно рассматривать как переход через возможный барьер. Фактически, в подавляющем большинстве хим реакций реагентами являются полностью самостоятельные сути, которые не очень нуждаются в соединении вместе. К примеру, лежит для себя уголь и лежит, необходимо приложить усилие, чтоб он начал пылать — т. е. соединяться с кислородом. Даже в этом, более ординарном примере самоподдерживающейся реакции окисления видно, что нужно затратить энергию и преодолеть возможный барьер, чтоб запустить реакцию.
Неважно какая молекула устойчива в меру той энергии, которую необходимо затратить на ее диссоциацию. Любые две молекулы в процессе хим реакции нужно поначалу разобрать с энергозатратой и только потом сумеют образоваться новые сути. Макроуправление таким процессом вещь очень дорогостоящая — к примеру, для сотворения качественных эпитаксиальных структур из GaAs нужно получить начальные очень незапятнанные вещества, а потом медлительно испарять их, контролируя поатомную сборку в подходящих положениях. Это страшные затраты энергии в расчете на атом, задачка их уменьшения безизбежно будет решаться.
По-видимому, нанотехнологии грядущего будут основаны на более тонких воздействиях на атомы, чем это практикуется на данный момент. Примером является катализ — так в химии именуется ускорение хим реакций в присутствии веществ-катализаторов, неоднократно вступающих в промежуточное хим взаимодействие с участниками реакции и восстанавливающих после каждого цикла собственный начальный хим состав.Условно каталитическая реакция изображена на рис. 4.20.
Рис. 4.20. Формула каталитической реакции А+В+К=С+Д+К,
А и В — начальные вещества,
К — катализатор,
С и Д — продукты реакции.
Можно представить для себя малыша на баскетбольной площадке, который пробует закинуть непосильный мяч в кольцо. Рядом стоит папа, который в некий момент подхватывает мяч и помогает закинуть его. Это прототип каталитической реакции: в исходный момент есть малыш с мячом и папа, который улыбается усилиям малыша. В конечный момент есть малыш, мяч в кольце и папа, который улыбается успеху малыша. Если не созидать промежную стадию, то и непонятно, чем посодействовал папа-катализатор.
Роль катализатора состоит в образовании промежного состояния, которое позволяет преодолеть пропасть в два прыжка (рис. 4.21).
Рис. 4.21. Условное изображение энергетического выигрыша, который достигается в каталитической реакции. Сплошной кривой изображена реакция без катализатора, Е1 — величина энергетического барьера для нее. Пунктирной кривой изображена каталитическая реакция, Е2 — величина энергетического барьера для нее; Е2 – Е1 — выигрыш в энергии. Дополнительный минимум на пунктирной кривой обозначает образование промежного комплекса начальных веществ и катализатора, т. е. изменение маршрута реакции.
На квантовом языке можно сказать, что без катализатора изначальное и конечное состояние разбиты настолько огромным барьером, что переход просит очень огромных издержек энергии. Создаваемое катализатором промежуточное состояние позволяет выполнить переход из исходного состояния в промежуточное, а потом в конечное с полностью применимыми энергозатратами. Значимая часть фурроров химии, также фактически все био процессы — каталитические, и конкретно на этом пути будут найдены новые, более действенные нанотехнологии.
Белки
Нанотехнологам уже удалось достигнуть кое-каких результатов. Но, чтоб показать дистанцию, которую еще предстоит пройти, попробую коротко обрисовать имеющиеся в природе наноструктуры. Какой-то из них является молекула гемоглобина. Основная функция гемоглобина — перенос молекул кислорода к органам и тканям организма. Молекулами гемоглобина заполнены красноватые кровяные клеточки — эритроциты. Всего в одном эритроците около 300 миллионов молекул гемоглобина. Любая из этих молекул состоит приблизительно из 104 атомов С, Н, О, N, S и 4 атомов железа, соответственно, за раз может присоединить и перенести 4 молекулы (либо, быстрее, молекулярных иона) кислорода.
Гемоглобин — это белок. Белки входят в состав всех живых организмов, но необыкновенную роль играют для животных организмов, которые состоят приемущественно из числа тех либо других форм белков. Мускулы, покровные ткани, внутренние органы, хрящи, кровь — все это белки. Белки представляют собой неразветвляющиеся полимеры ?–аминокислот. Обыкновенные белки состоят только из аминокислот и именуются протеинами, сложные белки содержат в качестве составных частей остатки соединений, принадлежащих к другим классам органических и неорганических веществ. Гемоглобин, естественно, относится к сложным белкам.
Аминокислотами именуются органические соединения, в молекуле которых содержатся сразу аминные NH2– и карбоксильные –COOH группы. Простая из аминокислот есть аминоуксусная кислота (глицин) NH2-CH2-COOH. Метод соединения аминокислот в полипептиды показан на рис. 4.22.
Но белками можно именовать только те полипептиды, которые способны самопроизвольно сформировывать и стабильно задерживать определенную пространственную конфигурацию. Для этого они должны быть довольно длинноватыми — иметь молекулярную массу более 6000, хотя это число является только условной границей. В 1952 году южноамериканский химик Лайнус Полинг показал, что более прибыльным расположением, которое осуществляется в почти всех пептидах и белках, является ?–спираль. Пептидные цепи ?–спирали свернуты так, что образуются водородные связи меж атомами водорода аминных групп и атомами кислорода карбоксильных групп через каждые три–четыре аминокислотных куска. Расстояние меж витками спирали 0,54 нм.
Рис. 4.22. Вверху — образование пептидной связи соединением 2-ух обычных аминокислот — глицина и аланина; понизу — ?-спираль (N, C — атомы азота и углерода, R — разные аминокислотные остатки).
Таким макаром, для описания структуры хоть какого белка нужно пройти несколько уровней. Первичная структура белка представляет собой специфическую последовательность аминокислот в полипептидной цепи (рис. 4.23а). Вторичная структура определяется методом, которым скручена цепь, а именно, ?–спираль (рис. 4.23б). Третичная структура белковой молекулы — это пространственная конфигурация, напоминающая малогабаритную глобулу (рис. 4.23в). Она поддерживается при помощи слабеньких связей: водородных, дисульфидных (S=S) и иных, также электростатическим взаимодействием. Для молекул белков, состоящих из нескольких полипептидных цепей, появляется четвертичная структура — как свернуты отдельные цепи вместе (рис. 4.23г). Очень значительно, что если каким-то образом размотать все эти цепочки и спирали, то, если не нарушена первичная структура белка, устройство молекулы самовосстанавливается!
Рис. 4.23. Структура белка:
а — первичная (линейное чередование тех либо других аминокислот);
б — вторичная (сворачивание линейного полипептида в альфа-спираль, появление внутренней упругости молекулы);
в — третичная (сворачивание спирали в более тесное образование за счет дополнительного сшивания слабенькими связями);
г — четвертичная (образование белковой глобулы из нескольких третичных цепей).
Молекула гемоглобина, находящегося в бардовых кровяных тельцах, состоит из 4 цепей: 2-ух ?-гемоглобина и 2-ух ?– гемоглобина (?-гемоглобин — цепь из 146 аминокислот, свернутая в спираль, напоминающую свернувшуюся змею). Совокупа этих 4 цепей определяет четвертичную структуру гемоглобина. Гемоглобин в качестве белкового компонента содержит глобин, а небелкового — гем. Видовые различия гемоглобина обоснованы глобином, в то время как гем схож у всех видов. Четыре цепи содержат четыре гема с атомом железа.
На рис. 4.24 показано, как устроен гем. Его важным элементом является порфириновое кольцо. Протопорфирин, присоединяя железо Fe(II), преобразуется в гем. Атом железа встраивается в кольцо из 4 атомов азота N. На рис. 4.24 показано, что железо связано с 2-мя атомами азота молекулы протопорфирина ковалентно, а с 2-мя другими атомами азота — координационными связями, обозначенными пунктирными линиями. Это дань представлению о двухвалентности железа. В действительности связи железа с 4-мя атомами азота симметричны. Конфигурация 6 валентных электронов Fe есть 3d6, в большинстве соединений железа атом находится в высокоспиновом состоянии, условно изображенном на рис. 4.25а9.
Рис. 4.24. Структурная формула гема: более принципиальное звено в процессе образования гема.
Рис. 4.25. Валентная электрическая конфигурация железа и схема роли атома железа в процессе связывания молекулы кислорода.
Для выполнения собственной принципиальной функции в гемоглобине железо перебегает в низкоспиновое состояние, условно изображенное на рис. 4.25б. В этом состоянии его радиус процентов на 20 меньше, чем в высокоспиновом состоянии, по другому этот атом просто не поместился бы в порфириновом кольце. Схема роли атома железа в процессе связывания молекулы кислорода изображена на рис. 4.25 понизу, а вид молекулы гемоглобина — на рис. 4.26. Поперечник молекулы гемоглобина приблизительно 6,4 нм, ее масса составляет около 65000 единиц, всего в ней более тыщи атомных групп. Молекула гемоглобина переносит молекулы кислорода массой 32 единицы и размером 0,12 нм, которым для этого следует попасть на то единственное место, где их ожидают — место расположения атома железа в геме.
Это и есть природная наноструктура, тот уровень трудности конструкций, с которым придется соревноваться нанотехнологу. Структура молекул гемоглобина (и миоглобина) была расшифрована английскими химиками Джоном Кендрью и Максом Перутцем (Нобелевская премия по химии 1962 года за исследование структуры глобулярных белков).
Рис. 4.26. Условное изображение молекулы гемоглобина; ? и ? цепи условно показаны различным цветом.
Дело, но, не только лишь в структуре. Молекула гемоглобина должна делать свою функцию: в подходящем месте присоединять и в другом месте отсоединять молекулы кислорода. Если рассматривать молекулу гемоглобина как статическую структуру, то этот процесс был бы неосуществим. Но связи в этой молекуле обеспечивают большущее число колебательных степеней свободы, отдельные атомные группы колеблются друг относительно друга, при этом амплитуда этих колебаний более чем в 10 раз превосходит амплитуду колебаний ядер в жестких телах. Таким макаром, молекула гемоглобина обеспечивает свои функции динамически. Ее комфортно сопоставить с автобусом, перевозящим пассажиров в час пик: автобус стопроцентно заполнен пассажирами, но в определенный момент в переднюю дверь входит очередной пассажир-кислород, протискивается на свободное место, выбирая момент, когда мешающие пассажиры переступят с ноги на ногу и позволят продвинуться, а потом принимает информацию о том, что пора выходить, и так же пробирается на подходящей остановке уже в дверь заднюю. Вот такие задачки должен научиться решать нанотехнолог.
1 Снова верну вас к словам Ричарда Фейнмана об базе современной картины мира, атомной догадке: все тела состоят из атомов…, которые находятся в беспрерывном движении, притягиваются на маленьком расстоянии, но отталкиваются, если их плотнее придавить друг к другу.
2 Для целей этой книги слабенькие связи противопоставляются ковалентным, употребляются в качестве синонима слова нековалентный.
3 Сравниваются размеры электронейтральных атомов в свободном состоянии, т. е. до образования ими хим связей либо т. н. слейтеровские радиусы.
4 Учите геометрию, господа будущие нанотехнологи!
5 Такие модификации именуются аллотропными — это существование 1-го и такого же хим элемента в виде 2-ух либо нескольких обычных веществ, разных по строению и свойствам. Внешний облик, физические и хим характеристики этих модификаций резко отличаются, невзирая на то, что в их образовании участвуют одни и те же атомы.
6 Создателями синтеза карбина были В. В. Коршак, А. М. Сладков, В. И. Касаточкин и Ю. П. Кудрявцев, работавшие в Институте элементоорганических соединений АН СССР; приметных практических применений карбина пока нет.
7 Симпатия химиков и Фуллера была обоюдной, вот что писал последний: …я уверял их обучаться всему тому, что можно взять у химии, потому что я чувствую, что химия есть основная структура и, как следует, архитектура.
8 Трубчатые молекулярные образования могут быть никак не только лишь углеродными, есть нанотрубки из слоистых дихалькогенидов переходных металлов, нитрид-борные нанотрубки и т. д.
9 Отсюда его ферромагнитные характеристики.
Источник:
www.gntc.ru/concept/?mode=tree&id=35