 Потаенны ледяных кристаллов
Потаенны ледяных кристаллов
Потаенны ледяных кристаллов
О. В. Мосин, И. Игнатов (Болгария)
Инструкция Значение льда в поддержании жизни на нашей планетке тяжело недооценить. Лёд оказывает огромное воздействие на условия обитания и жизнедеятельности растений и животных и на различные виды хозяйственной деятельности человека. Покрывая воду, лед из-за собственной низкой плотности играет в природе роль плавучего экрана, защищающего реки и водоемы от предстоящего замерзания и сохраняющего жизнь подводным обитателям. Внедрение льда в разных целях (снегозадержание, устройство ледяных переправ и изотермических складов, льдозакладка хранилищ и шахт) представляет предмет ряда разделов гидрометеорологических и инженерно-технических наук, таких как ледотехника, снеготехника, инженерное мерзлотоведение, также деятельности особых служб ледовой разведки, ледокольного транспорта и снегоуборочной техники. Природный лёд употребляется для хранения и остывания пищевых товаров, био и мед препаратов, зачем он специально делается и заготавливается, а талую воду, приготовленную при плавлении льда употребляют в народной медицине – для увеличения обмена веществ и выведения шлаков из организма. Статья знакомит читателя с новыми малоизвестными качествами и модификациями льда.
Лёд – кристаллическая форма воды, владеющая по последним данным четырнадцатью структурными модификациями. Посреди их имеются и кристаллические (природный лед) и бесформенные (кубический лед) и метастабильные модификации, различающиеся друг от друга обоюдным расположением и физическими качествами молекул воды, связанными водородными связями, формирующими кристаллическую решетку льда. Они все не считая обычного нам природного льда Ih, кристаллизующего в гексагональной решетке, образуются в критериях экзотичных — при очень низких температурах сухого льда и водянистого азота и больших давлениях в тыщи атмосфер, когда углы водородных связей в молекуле воды меняются и образуются кристаллические системы, хорошие от гексагональной. Такие условия напоминают галлактические и не встречаются на Земле.
В природе лёд представлен приемущественно, одной кристаллической разновидностью, кристаллизующейся в гексагональной решётке, напоминающей структуру алмаза, где любая молекула воды окружена 4-мя наиблежайшими к ней молекулами, находящимися на схожих расстояниях от нее, равных 2,76 ангстрем и размещенных в верхушках правильного тетраэдра [1]. В связи с низким координационным числом структура льда является сетчатой, что оказывает влияние на его невысокую плотность, составляющая 0,931 г/см3.
Самое необыкновенное свойство льда — это необычное обилие наружных проявлений. При одной и той же кристаллической структуре он может смотреться совсем по-разному, принимая форму прозрачных градин и сосулек, хлопьев лохматого снега, плотной блестящей корки льда либо циклопических ледниковых масс. Лёд встречается в природе в виде материкового, плавающего и подземного льда, также в виде снега и инея. Он распространён во всех областях обитания человека. Собираясь в огромных количествах, снег и лед сформировывают особенные структуры с принципно другими, чем у отдельных кристаллов либо снежинок, качествами. Природный лед сформирован в главном льдом осадочно-метаморфического происхождения, образовавшимся из жестких осадков в итоге следующего уплотнения и перекристаллизации. Соответствующая особенность природного льда — зернистость и полосчатость. Зернистость обоснована процессами рекристаллизации; каждое зерно ледникового льда представляет собой кристалл неверной формы, тесновато примыкающий к другим кристаллам в ледяной толще таким макаром, что выступы 1-го кристалла плотно входят в углубления другого. Таковой лед получил заглавие поликристаллического. В нем каждый кристалл льда представляет собой слой тончайших листочков, налегающих друг на друга в базовой плоскости, перпендикулярной к направлению оптической оси кристалла.
Общие припасы льда на Земле составляют согласно расчетам около 30 млн. км3 (табл. 1). Больше всего льда сосредоточено в Антарктиде, где толщина его слоя добивается 4 км. Также имеются данные о наличии льда на планетках Галлактики и в кометах. Лед имеет настолько огромное значение для климата нашей планетки и обитания на ней живых созданий, что ученые обозначили для льда необыкновенную среду — криосферу, границы которой простираются высоко в атмосферу и глубоко в земную кору [2].
Табл. 1. Количество, распространение и время жизни льда.
Вид льда
Масса
Площадь распространения
Средняя концентрация, г/см2
Скорость прироста массы, г/год
Среднее время жизни, год
г
%
млн. км2
%
Ледники
2,4·1022
98,95
16,1
10,9
суши
1,48·105
2,5·1018
9580
Подземный лёд
2·1020
0,83
21
14,1
суши
9,52·103
6·1018
30—75
Морской лёд
3,5·1019
0,14
26
7,2
океана
1,34·102
3,3·1019
1,05
Снежный покров
1,0·1019
0,04
72,4
14,2
Земли
14,5
2·1019
0.3—0,5
Айсберги
7,6·1018
0,03
63,5
18,7
океана
14,3
1,9·1018
4,07
Атмосферный лёд
1,7·1018
0,01
510,1
100
Земли
3,3·10—1
3,9·1020
4·10—3
Кристаллы льда неподражаемы по собственной форме и пропорциям. Хоть какой возрастающий природный кристалл, включая кристалл льда льда всегда стремится сделать безупречную правильную кристаллическую решетку, так как это прибыльно исходя из убеждений минимума его внутренней энергии. Любые примеси, как понятно, искажают форму кристалла, потому при кристаллизации воды сначала в решётку встраиваются молекулы воды, а посторонние атомы и молекулы примесей вытесняются в жидкость. И только когда примесям деваться уже некуда, кристалл льда начинает встраивать их в свою структуру либо оставляет в виде полых капсул с концентрированной незамерзающей жидкостью — рассолом. Потому морской лёд пресный и даже самые грязные водоемы покрываются прозрачным и незапятнанным льдом. При плавлении льда он теснит примеси в рассол. В планетарном масштабе парадокс замерзания и таяния воды, вместе с испарением и конденсацией воды, играет роль огромного очищающего процесса, в каком вода на Земле повсевременно очищает сама себя [3].
Табл. 2. Некие физические характеристики льда I.
Свойство
Значение
Примечание
Теплоемкость, кал/(г·°C)
Теплота таяния, кал/г
Теплота парообразования, кал/г
0,51 (0 °C)
79,69
677
Очень миниатюризируется с снижением температуры
Коэффициент теплового расширения, 1/°C
9,1·10-5 (0 °C)
Поликристаллический лёд
Теплопроводимость, кал/(см·сек·°C)
4,99·10 –3
Поликристаллический лёд
Показатель преломления:
1,309 (-3 °C)
Поликристаллический лёд
Удельная электронная проводимость, ом-1·см-1
10-9 (0 °C)
Кажущаяся энергия активации 11 ккал/моль
Поверхностная электропроводность, ом-1
10-10 (-11°C)
Кажущаяся энергия активации 32 ккал/моль
Модуль упругости Юнга, дин/см2
9·1010 (-5 °C)
Поликристаллический лёд
Сопротивление, МН/м2 :
раздавливанию
разрыву
срезу
2,5
1,11
0,57
Поликристаллический лёд
Поликристаллический лёд
Поликристаллический лёд
Динамическая вязкость, пуаз
1014
Поликристаллический лёд
Энергия активации при деформировании и механической релаксации, ккал/моль
11,44-21,3
Линейно вырастает на 0,0361 ккал/(моль·°C) от 0 до 273,16 К
Примечание: 1 кал/(г·°С)=4,186 кДж/(кг·К); 1 ом-1·см-1=100 сим/м; 1 дин = 10-5 Н; 1 Н = 1 кг·м/с?; 1 дин/см=10-7 Н/м; 1 кал/(см·сек°С)=418,68 вт/(м·К); 1 пуаз=г/см·с = 10-1 Н сек/м2.
В связи с широким распространением льда на Земле, отличие физических параметров льда (табл. 2) от параметров других веществ играет важную роль в почти всех природных процессах [4]. Лёд обладает многими другими полезными для поддержания жизни качествами и аномалиями – аномалиями плотности, давления, объема, теплопроводимости. Если б не было водородных связей, сцепляющих молекулы воды в кристалл, лед расплавлялся бы при –90 °С. Но этого не происходит из-за наличия водородных связей меж молекулами воды. Вследствие наименьшей, чем у воды, плотности лёд образует на поверхности воды плавучий покров, предохраняющий реки и водоёмы от донного замерзания, так как его теплопроводимость намного меньше, чем воды. При всем этом меньшая плотность и объем наблюдается при +3,98 °С (рис. 1). Предстоящее остывание воды до 0 0С равномерно приводит не к уменьшению, а к повышению ее объема практически на 10%, когда вода преобразуется в лед. Такое поведение воды свидетельствует об одновременном существовании в воде 2-ух сбалансированных фаз – водянистой и квазикристаллической по аналогии с квазикристаллами, кристаллическая решетка которых имеет не только лишь периодическое строение, да и обладает осями симметрии различных порядков, существование которых ранее противоречило представлениям кристаллографов [5]. Эта теория, в первый раз выдвинутая известным российским физиком-теоретиком Я. И. Френкелем, базирована на предположении, что часть молекул воды образует квазикристаллическую структуру, тогда как другие молекулы являются газоподобными, свободно передвигающимися по объему. Рассредотачивание молекул в малой округи хоть какой фиксированной молекулы воды имеет определенную упорядоченность, несколько напоминающую кристаллическую, хотя и поболее рыхлую [6]. По этой причине структуру воды время от времени именуют квазикристаллической либо кристаллоподобной, т. е. обладающей симметрией и наличием упорядоченность во обоюдном расположении атомов либо молекул.
Рис. 1. Зависимость удельного объема льда и воды от температуры
Другое свойство заключается в том, что скорость течения льда прямо пропорциональна энергии активации и назад пропорциональна абсолютной температуре, так что с снижением температуры лёд приближается по своим свойствам к полностью твёрдому телу. В среднем при близкой к таянию температуре текучесть льда в 106 раз выше, чем у горных пород [7]. Благодаря собственной текучести лёд не накопляется в одном месте, а в виде ледников повсевременно перемещается. Зависимость меж скоростью течения и напряжением у поликристаллического льда гиперболическая; при приближённом описании её степенным уравнением показатель степени возрастает по мере роста напряжения.
Видимый свет льдом фактически не поглощается, так как световые лучи проходят кристалл льда насквозь, но задерживает уф-излучение и огромную часть инфракрасного излучения Солнца. В этих областях диапазона лёд смотрится полностью чёрным, так как коэффициент поглощения света в этих областях диапазона очень велик. В отличие от кристаллов льда, белоснежный свет, падающий на снег, не поглощается, а неоднократно преломляется в ледяных кристаллах и отражается от их граней. Потому снег смотрится белоснежным.
Вследствие очень высочайшей отражательной возможности льда (0,45) и снега (до 0,95) покрытая ими площадь — в среднем за год около 72 млн. км2 в больших и средних широтах обоих полушарий — получает солнечного тепла на 65% меньше нормы и является массивным источником остывания земной поверхности, чем в значимой мере обоснована современная широтная климатическая зональность. Летом в полярных областях солнечная радиация больше, чем в экваториальном поясе, все же температура остаётся низкой, т. к. значимая часть поглощаемого тепла затрачивается на таяние льда, имеющего очень высшую теплоту таяния.
К другим необыкновенным свойствам льда относят и генерацию электрического излучения его возрастающими кристаллами [8]. Понятно, что большая часть растворенных в воде примесей не передаются льду, когда он начинает расти; они вымораживается. Потому даже на самой грязной луже пленка льда незапятнанная и прозрачная. При всем этом примеси накапливаются на границе жесткой и водянистой сред, в виде 2-ух слоев электронных зарядов различного знака, которые вызывают значительную разность потенциалов. Заряженный слой примесей перемещается совместно с нижней границей юного льда и испускает электрические волны. Благодаря этому процесс кристаллизации можно следить в деталях. Так, кристалл, возрастающий в длину в виде иголки, испускает по другому, чем покрывающийся боковыми отростками, а излучение возрастающих зернышек отличается от того, что появляется, когда кристаллы лопаются. По форме, последовательности, частоте и амплитуде импульсов излучения можно найти, с какой скоростью леденеет лед и какая при всем этом формируется ледовая структура.
Но самое необычное в структуре льда состоит в том, что молекулы воды при низких температурах и больших давлениях снутри углеродных нанотрубок могут кристаллизоваться в форме двойной спирали, напоминающей молекулы ДНК. Это было подтверждено недавнешними компьютерными тестами американских учёных под управлением Сяо Чэн Цзэна из Институте штата Небраска (США). Чтоб вода сформировала спираль в моделируемом опыте она помещалась в нанотрубки поперечником от 1,35 до 1,90 нм под высочайшим давлением, варьирующимися от 10 до 40000 атмосфер и задавалась температура –23 °C [9]. Ожидалось узреть, что вода во всех случаях образует узкую трубчатую структуру. Но, модель показала, что при поперечнике нанотрубки в 1,35 нм и наружном давлении 40000 атмосфер водородные связи в структуре льда скривились, что привело к образованию спирали с двойной стеной – внутренней и наружной. Внутренняя стена в этих критериях оказалась скрученной в четыре спиралью, а наружняя стена состояла из четырёх двойных спиралей, схожих на молекулу ДНК (рис. 2). Этот факт может служить доказательством связи структуры жизненно-важной молекулы ДНК со структурой самой воды и что вода служила матрицей для синтеза молекул ДНК.
Рис. 2. Компьютерная модель структуры замерзшей воды в нанотрубках, напоминающая молекулу ДНК (Фото из журнальчика New Scientist, 2006)
Другое из важных параметров воды, открытых исследованых в ближайшее время, состоит в том, что вода обладает способностью запоминать информацию о прошедших воздействиях. Это в первый раз обосновали японский исследователь Масару Эмото [10] и наш соотечественник Станислав Зенин [11], одним из первых предложивший кластерную теорию строения воды, состоящей из повторяющихся ассоциатов большой полиэдрической структуры – кластеров общей формулы (Н2О)n, где n по последним данным может достигать сотен и даже тыщ единиц. Конкретно благодаря наличию в воде кластеров вода обладает информационными качествами. Исследователи фотографировали процессы замораживания воды в микрокристаллы льда, действуя на неё разными электрическими и акустическими полями, мелодиями, молитвой, словами либо идеями. Оказалось, что под действием положительной инфы в виде прекрасных мелодий и слов лёд замораживался в симметричные шестигранные кристаллы. Там, где звучала неритмичная музыка, злые и оскорбительные слова, вода, напротив, леденела в беспорядочные и аморфные кристаллы. Это является подтверждением того, что вода обладает особенной, чувствительной к наружным информационным воздействиям структурой. Предположительно мозг человека, состоящий на 85-90% из воды, обладает сильным структурирующим воздействием на воду.
Кристаллы Эмото вызывают сразу энтузиазм и недостаточно обоснованную критику. Если разглядеть их пристально, можно узреть, что их структура состоит из 6 верхов. Но еще больше внимательный анализ указывает, что у снежинок зимой такая же структура, всегда симметричная и с шестью верхами. В какой степени кристализованные структуры содержат информацию об окружении, где были сделаны? Структура снежинок может быть прекрасной либо аморфной. Это показывает на то, что контрольная проба (скопление в атмосфере), где они появляются, оказывает на их такое же воздействие, как и начальные условия. Первоначальными критериями являются солнечная активность, температура, геофизические поля, влажность и др. Все это означает, что из т.н. среднего ансамбля можно прийти к выводу о примерно схожей структуре аква капель, а потом и снежинок. Их масса практически схожа, и они двигаются в атмосфере с похожей скоростью. В атмосфере они продолжают оформлять свои структуры и возрастать в объеме. Даже если они сформировались в различных частях облака, в одной группе всегда есть определенное количество снежинок, появившихся при практически схожих критериях. А ответ на вопрос, что представляет собой положительная и отрицательная информация о снежинках, можно находить у Эмото. В лабораторных критериях негативная информация (землетрясение, неблагоприятные для человека звуковые вибрации и т.д.) не образует кристаллы, а положительная информация, как раз напротив. Очень любопытно, в какой степени один фактор может оформить однообразные либо подобные структуры снежинок. Большая плотность воды наблюдается при температуре 4 °C. Научно подтверждено, что плотность воды миниатюризируется, когда начинают создаваться шестиугольные ледяные кристаллы при снижении температуры ниже нуля. Это является результатом деяния водородных связей меж молекулами воды.
Какова причина подобного структурирования? Кристаллы представляют собой твердые тела, а составляющие их атомы, молекулы либо йоны размещены в правильной, циклической структуре, в 3-х пространственных измерениях. Структура аква кристаллов малость отличается. По воззрению Айзека, всего только 10% водородных связей во льде являются ковалентными, т.е. с довольно размеренной информацией. Водородные связи меж кислородом одной молекулы воды и водородом другой проявляют самую большую чувствительность к наружным воздействиям. Диапазон воды при построении кристаллов относительно разный во времени. Согласно доказанному Антоновым и Юскеселиевым эффекту дискретного испарения аква капли и его зависимости от энергетических состояний водородных связей, мы можем находить ответ насчет структурирования кристаллов. Любая часть диапазона находится в зависимости от поверхностного напряжения водяных капель. В диапазоне 6 пиков, которые указывают на разветвления снежинки.
Разумеется то, что в опытах Эмото исходная «контрольная» проба влияет с виду кристаллов. Это значит то, что после воздействия определенного фактора, можно ждать формирование схожих кристаллов. Практически нереально получить однообразные кристаллы. При проверке воздействия слова »любовь» на воду, Эмото не показывает ясно, был ли данный опыт осуществлен с различными пробами.
Нужны вдвойне слепые опыты для того, чтоб проверить, довольно ли дифференцирована методика Эмото. Подтверждение Айзека о том, что 10% водяных молекул после замерзания образуют ковалентные связи, указывает нам, что вода употребляет при замерзании данную информацию. Достижение Эмото даже и без вдвойне слепых тестов остается довольно принципиальным в отношении информационных параметров воды.

Природная снежинка, Уилсон Бентли, 1925
Снежинка Эмото, приобретенная из природной воды
Одна снежинка — природная, а другая — сделанная Эмото, показывает на то, что обилие в водяном диапазоне не беспредельно.
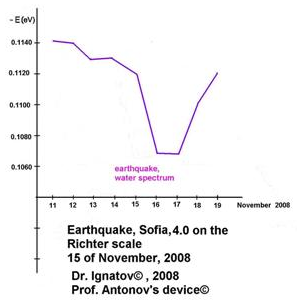
Earthquake, Sofia, 4.0 Richter scale, 15 November 2008,
Dr. Ignatov, 2008©, Prof. Antonov’s device©
15 ноября 2008 г. в Софии было записанно землетрясение 4,0 степени по Рихтеру.
Данная фигура показывает на разницу меж контрольной пробой и изготовленными в другие деньки. Молекулы воды разрывают более энерго водородные связки в воде, также два пика в диапазоне во время природного явления. Исследование было проведено с помощью прибора Антонова. Биофизический итог указывает снижение актуального тонуса организма при землетрясении. Во время землетрясения вода не может поменять свою структуру в снежинках в лаборатории Эмото. Есть подтверждения об изменении электропроводимости воды во время землетрясения.
В 1963 г. танзанийский школьник Эрасто Мпемба увидел, что жгучая вода леденеет резвее прохладной. Этот парадокс получил заглавие эффект Мпемба. Хотя уникальное свойство воды было увидено намного ранее Аристотелем, Френсисом Беконом и Рене Декартом. Явление было подтверждено неоднократно целым рядом независящих друг от друга тестов. У воды есть и очередное странноватое свойство. По моему воззрению, разъяснение этому последующее: у дифференциально неравновесного энергетического диапазона (ДНЭС) кипяченой воды наименьшая средняя энергия водородных связок меж водяными молекулами, чем у пробы, взятой при комнатной температуре Это означает, что кипяченой воде нужно меньше энергии для того, чтоб начать структурировать кристаллы и замерзнуть.
Разгадка структуры льда и его параметров заключается в строении его кристалла. Кристаллы всех модификаций льда построены из молекул воды H2O, соединённых водородными связями в трёхмерные сетчатые каркасы с определенным расположением водородных связей. Молекулу воды можно упрощенно представить для себя в виде тетраэдра (пирамиды с треугольным основанием) [12]. В её центре находится атом кислорода, находящийся в состоянии sp3-гибридизации, а в 2-ух верхушках — по атому водорода, по одному из 1s-электронов которых задействованы в образовании ковалентной Н-О связи с кислородом. Две оставшиеся верхушки занимают пары неспаренных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей, потому их именуют неподеленными. Пространственная форма молекулы Н2О разъясняется обоюдным отталкиванием атомов водорода и неподеленных электрических пар центрального атома кислорода.
Водородная связь имеет принципиальное значение в химии межмолекулярных взаимодействий и обоснована слабенькими электростатическими силами и донорно-акцепторными взаимодействиями [13]. Она появляется при содействии электронодефицитного электронами атома водорода одной молекулы воды с неподеленной электрической парой атома кислорода примыкающей молекулы воды (О-Н…О). Отличительной особенностью водородной связи является сравнимо низкая крепкость; она в 5-10 раз слабее хим ковалентной связи [14]. По энергии водородная связь занимает среднее положение меж хим связью и ван-дер-ваальсовыми взаимодействиями, удерживающими молекулы в жесткой либо водянистой фазе [15]. Любая молекула воды в кристалле льда может сразу создавать четыре водородные связи с другими примыкающими молекулами под строго определенными углами, равными 109°47′, направленных к верхушкам тетраэдра, которые не позволяют при замерзании воды создавать плотную структуру (рис. 3). В структурах льда I, Ic, VII и VIII этот тетраэдр верный. В структурах льда II, III, V и VI тетраэдры приметно искажены [16]. В структурах льда VI, VII и VIII можно выделить две взаимоперекрещивающиеся системы водородных связей. Этот невидимый каркас из водородных связей располагает молекулы воды в виде сетчатой сетки, по структуре напоминающей шестигранные соты с полыми внутренними каналами. Если лед подогреть, сетчатая структура разрушается: молекулы воды начинают проваливаться в пустоты сетки, приводя к более плотной структуре воды, — этим разъясняется, почему вода тяжелее льда.
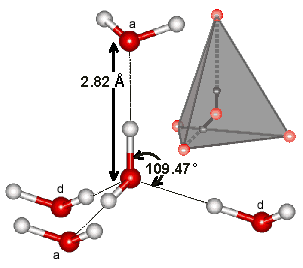
Рис. 3. Образование водородной связи меж 4-мя молекулами Н2О (красноватые шарики обозначают центральные атомы кислорода, белоснежные шарики – атомы водорода)
Специфичность водородных связей и межмолекулярных взаимодействий, соответствующая для структуры льда, сохраняется в талой воде, потому что при плавлении кристалла льда разрушается только 15% всех водородных связей. Потому присущая льду связь каждой молекулы воды с 4-мя примыкающими («ближний порядок») не нарушается, хотя и наблюдается бoльшая размытость кислородной каркасной решетки. Водородные связи могут сохраняться и при кипении воды. Только в водяном пару водородные связи отсутствуют.
Лед, который появляется при атмосферном давлении и плавится при 0 °С, — самое обычное, но всё же до конца не изученное вещество. Почти все в его структуре и свойствах смотрится особенно. В узлах кристаллической решетки льда атомы кислорода тетраэдров молекул воды выстроены упорядоченно, образуя правильные шестиугольники, наподобие шестигранных пчелиных сот, а атомы водорода занимают самые различные положения на соединяющих атомы кислорода водородных связях (рис. 4). Потому вероятны 6 эквивалентных ориентаций молекул воды относительно их соседей. Часть из их исключается, так как нахождение сразу 2-ух протонов на одной водородной связи маловероятно, но остаётся достаточная неопределённость в ориентации молекул воды. Такое поведение атомов необычно, так как в жестком веществе все атомы подчиняются одному закону: или они атомы размещены упорядоченно, тогда и это — кристалл, или случаем, тогда и это — бесформенное вещество. Такая необыкновенная структура может реализоваться в большинстве модификаций льда — Ih, III, V, VI и VII (и по-видимому в Ic) (табл. 3), а в структуре льда II, VIII и IX молекулы воды ориентационно упорядочены. По выражению Дж. Бернала лёд кристалличен в отношении атомов кислорода и стеклообразен в отношении атомов водорода.
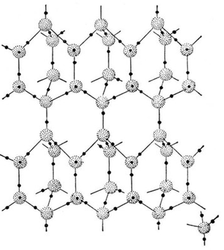
Рис. 4. Структура льда природной гексагональной конфигурации Ih
В других критериях, к примеру в Космосе при огромных давлениях и низких температурах, лёд кристаллизуется по другому, образуя другие кристаллические решетки и модификации (кубическая, тригональная, тетрагональная, моноклинная и др.), любая из которых обладает своей структурой и кристаллической решеткой (табл. 3). Структуры льдов разных модификаций были расчитаты русскими исследователями д.х.н. Г.Г. Маленковым и к.физ.-мат.н. Е.А. Желиговской из Института физической химии и электрохимии им. А.Н. Фрумкина Русской академии [17]. Льды II, III и V-й модификации долгое время сохраняются при атмосферном давлении, если температура не превосходит -170 °С (рис. 5). При охлаждении примерно до -150 °С природный лёд преобразуются в кубический лёд Ic, состоящий из кубов и октаэдров размером в несколько нанометров [18]. Лед Ic время от времени возникает и при замораживании воды в капиллярах, чему, видимо, содействует взаимодействие воды с материалом стены и повторение его структуры. Если температура чуток выше -110 0C, на железной подложке формируются кристаллы более плотного и томного стеклообразного бесформенного льда с плотностью 0,93 г/см3 [19]. Обе эти формы льда могут самопроизвольно перебегать в гексагональный лёд, причём тем резвее, чем выше температура.
Табл. 3. Некие модификации льда и их физические характеристики.
Модификация
Кристаллическая структура
Длины водородных связей, A
Углы Н—О—Н в тетраэдрах, 0
I
Ic
II
III
V
VI
VII
VIII
IX
Гексагональная
Кубическая
Тригональная
Тетрагональная
Моноклинная
Тетрагональная
Кубическая
Кубическая
Тетрагональная
2,76
2,76
2,75—2,84
2,76—2,8
2,76—2,87
2,79—2,82
2,86
2,86
2,76—2,8
109,5
109,5
80—128
87—141
84—135
76—128
109,5
109,5
87—141
Примечание. 1 A = 10-10 м
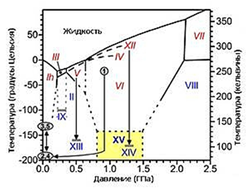
Рис. 5. Диаграмма состояния кристаллических льдов разных модификаций.
Есть и льды высочайшего давления — II и III тригональной и тетрагональной модификаций, образованные из полых соток, сформированных шестиугольными гофрированными элементами, сдвинутыми друг относительно друга на одну третья часть (рис. 6 и рис. 7). Эти льды стабилизируются в присутствии великодушных газов гелия и аргона. В структуре льда V моноклинной модификации углы меж примыкающими атомами кислорода составляют от 860 до 132°, что очень отличается от валентного угла в молекуле воды, составляющем 105°47’. Лед VI тетрагональной модификации состоит из 2-ух вставленных друг в друга каркасов, меж которыми нет водородных связей, в итоге чего формируется объёмоцентрированная кристаллическая решётка (рис. 8). Базу структуры льда VI составляют гексамеры — блоки из 6 молекул воды. Их конфигурация в точности повторяет строение устойчивого кластера воды, которую дают расчёты. Аналогичную структуру с каркасами льда I, вставленных друг в друга, имеют льды VII и VIII кубической модификации, которые являеются низкотемпературными упорядоченными формами льда VII. При следующем увеличении давления расстояние меж атомами кислорода в кристаллической решетке льдов VII и VIII будет уменьшаться, в итоге формируется структура льда X, атомы кислорода в каком выстроены в правильную решётку, а протоны упорядочены. 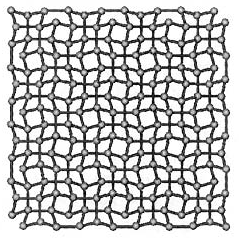
Рис. 7. Лед III-й конфигурации [17].
Лед XI появляется при глубочайшем охлаждении льда Ih c добавкой щелочи ниже 72 К при обычном давлении. В этих критериях образуются гидроксильные недостатки кристалла, дозволяющие растущему кристаллу льда изменять свою структуру. Лед XI обладает ромбической кристаллической решёткой с упорядоченным расположением протонов и формируется сходу в почти всех центрах кристаллизации около гидроксильных изъянов кристалла.

Рис. 8. Лед VI конфигурации [17].
Посреди льдов имеются и метастабильные формы IV и XII, времена жизни которых составляют секунды, владеющие самой прекрасной структурой (рис. 9 и рис. 10). Для получения метастабильных льдов необходимо сжимать лёд Ih до давления 1,8 ГПа при температуре водянистого азота. Эти льды образуются еще легче и в особенности размеренны, если давлению подвергается переохлажденная тяжёлая вода. Другая метастабильная модификация — лёд IX появляется при переохлаждении льда III и по существу представляет собой его низкотемпературную форму.
Рис. 9. Лед IV-конфигурации [17].
Две последние модификации льда — с моноклинной XIII и ромбической конфигурацией XIV были открыты учеными из Оксфорда (Англия) совершенно не так давно — в 2006 году. Предположение о том, что должны существовать кристаллы льда с моноклинной и ромбической решетками, было тяжело 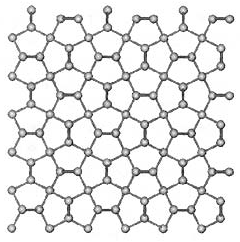
Рис. 10. Лёд XII конфигурации [17].
подтвердить: вязкость воды при температуре -160 °С очень высока, и собраться совместно молекулам незапятанной переохлажденной воды в таком количестве, чтоб образовался эмбрион кристалла, тяжело. Этого удалось достигнуть при помощи катализатора — соляной кислоты, которая повысила подвижность молекул воды при низких температурах. На Земле подобные модификации льда создаваться не могут, но они могут существовать в Космосе на остывших планетках и замерзших спутниках и кометах. Так, расчёт плотности и термических потоков с поверхности спутников Юпитера и Сатурна позволяет утверждать, что у Ганимеда и Каллисто должна быть ледяная оболочка, в какой чередуются льды I, III, V и VI. У Титана льды образуют не кору, а мантию, внутренний слой которой состоит из льда VI, других льдов высочайшего давления и клатратных гидратов, а сверху размещен лёд Ih.
Высоко в атмосфере Земли при низкой температуре вода кристаллизуется из тетраэдров, формирующих гексагональный лед Ih. Центром образования кристаллов льда является твердые частички пыли, которые поднимает в верхние слои атмосферы ветер. Вокруг этого зародышевого микрокристалла льда в 6 симметричных направлениях нарастают иголочки, образованные отдельными молекулами воды, на которых растут боковые отросточки — дендриты. Температура и влажность воздуха вокруг снежинки схожи, потому вначале она симметрична по собственной форме. По мере формирования снежинки равномерно опускаются в более низкие слои атмосферы, где температура выше. 
Рис. 11. Обилие и форма снежинок в природе
Тут происходит плавление и их безупречная геометрическая форма искажается, формируя обилие снежинок (рис. 11).
При предстоящем плавлении гексагональная структура льда разрушается и появляется смесь повторяющихся ассоциатов кластеров, также из три-, тетра-, пента-, гекса-меров воды (рис. 12) и свободных молекул воды. Исследование строения образующихся кластеров нередко существенно затруднено, так как вода по современным данным – смесь разных нейтральных кластеров (Н2О)n и их заряженных кластерных ионов [Н2О]+n и [Н2О]-n, находящихся в динамическом равновесии меж собой с течением времени жизни 10-11-10-12 секунд [20].
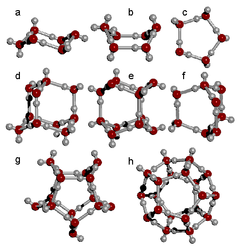
Рис. 12. Вероятные кластеры воды (а-h) состава (Н2О)n, где n = 5-20.
Кластеры способны вести взаимодействие вместе за счет выступающих наружу граней водородных связей, образуя более сложные полиэдрические структуры, такие как гексаэдр, октаэдр, икосаэдр и додекаэдр. Таким макаром, структура воды связана с так именуемыми Платоновыми телами (тетраэдр, гексаэдр, октаэдр, икосаэдр и додекаэдр), нареченными в честь открывших их древнегреческого философа и геометра Платона, форма которых определяется золотой пропорцией (рис. 13).
Рис. 13. Платоновы тела, геометрическая форма которых определяется золотой пропорцией.
Число вершин (В), граней (Г) и рёбер (Р) в любом пространственном полиэдре описывается соотношением:
В + Г = Р + 2
Отношение количества вершин (В) правильного полиэдра к количеству рёбер (Р) одной его грани равно отношению количества граней (Г) этого же полиэдра к количеству рёбер (Р), выходящих из одной его верхушки. У тетраэдра это отношение равно 4:3, у гексаэдра (6 граней) и октаэдра (8 граней) — 2:1, а у додекаэдра (12 граней) и икосаэдра (20 граней) — 4:1.
Стуктуры полиэдрических кластеров воды, расчитаные русскими учеными, были доказаны при помощи современных способов анализа: спектроскопией протонного магнитного резонанса, фемтосекундной лазерной спектроскопией, дифракцией рентгеновских лучей и нейтронов на кристаллах воды [21]. Открытие кластеров воды и способность воды хранить информацию – два важнейших открытия XXI тысячелетия. Это наглядно обосновывает, что природе свойственна симметрия в виде четких геометрических форм и пропорций, соответствующим кристаллам льда.
ЛИТЕРАТУРА.
1. Белянин В., Романова Е. Жизнь, молекула воды и золотая пропорция // Наука и жизнь, 2004, Т. 10, № 3, с. 23-34.
2. Шумский П. А., Базы структурного ледоведения. — Москва, 1955б с. 113.
3. Мосин О.В., Игнатов И. Понимание воды как субстанции жизни. // Сознание и физическая действительность. 2011, Т 16, № 12, с. 9-22.
4. Петрянов И. В. Самое необычное вещество в мире.Москва, Педагогика, 1981, с. 51-53.
5 Эйзенберг Д, Кауцман В. Строение и характеристики воды. – Ленинград, Гидрометеоиздат, 1975, с. 431.
6. Кульский Л. А., Даль В. В., Ленчина Л. Г. Вода знакомая и таинственная. – Киев, Родянбска школа, 1982, с. 62-64.
7. Зацепина Г. Н. Структура и характеристики воды. – Москва, изд. МГУ, 1974, с. 125.
8. Антонченко В. Я., Давыдов Н. С., Ильин В. В. Базы физики воды — Киев, Наукова думка, 1991, с. 167.
9. Simonite T. DNA-like ice ‘seen’ inside carbon nanotubes // New Scientist, V. 12, 2006.
10. Эмото М. Послания воды. Потаенные коды кристаллов льда. — София, 2006. с. 96.
11. Зенин С. В., Тяглов Б. В. Природа гидрофобного взаимодействия. Появление ориентационных полей в аква смесях // Журнальчик физической химии, 1994, Т. 68, № 3, с. 500-503.
12. Пиментел Дж., Мак-Клеллан О. Водородная связью — Москва, Наука, 1964, с. 84-85.
13. Бернал Дж., Фаулер Р. Структура воды и ионных смесей // Успехи физических наук, 1934, Т. 14, № 5, с. 587-644.
14. Хобза П., Заградник Р. Межмолекулярные комплексы: Роль Ван-дер-ваальсовых систем в физической химии и биодисциплинах. – Москва, Мир, 1989, с. 34-36.
15. Паундер Э. Р. Физика льда, пер. с англ. — Москва, 1967, с. 89.
16. Комаров С. М. Ледяные узоры высочайшего давления. // Химия и жизнь, 2007, №2, С. 48-51.
17. Е. А. Желиговская, Г. Г. Маленков. Кристаллические льды // Успехи химии,2006, № 75, с. 64.
18. Fletcher N. H. The chemical physics of ice, Cambreage, 1970.
19. Немухин А. В. Обилие кластеров // Русский хим журнальчик, 1996, Т. 40, № 2, с. 48-56.
20. Мосин О.В., Игнатов И. Структура воды и физическая действительность. // Сознание и физическая действительность, 2011, Т. 16, № 9, с. 16-32.
21. Игнатов И. Биоэнергетическая медицина. Зарождение живой материи, память воды, биорезонанс, биофизические поля. — ГеяЛибрис, София, 2006, с. 93.