 Томная вода и адаптация к ней клеток
Томная вода и адаптация к ней клеток
Томная вода и адаптация к ней клеток
О. В. МОСИН
Столичная муниципальная академия узкой хим технологии им. М.В. Ломоносова, 117571, Москва, просп. Вернадского, д. 86.
Тяжёлая вода отличается от обыкновенной воды молекулярной массой. В молекуле тяжёлой воды в отличие от обыкновенной воды заместо 2-ух атомов водорода, связанных ковалентной связью с атомом кислорода в молекуле эти два атома водорода замещены на дейтерий. Атом дейтерия, как изотоп водорода содержит однообразное количество положительно заряженных частиц протонов, но различается от атома водорода содержанием не положительно и не отрицательно заряженных частиц нейтронов, которых в атоме дейтерия 2. Различие в нуклеарной массе атомов водорода и дейтерия и определяет те гидрофобные эффекты, которые тяжёлая вода оказывает на клеточки и организм.
Принципиальной неувязкой является адаптация клеточки к тяжёлой воде. Длительное время числилось, что тяжёлая вода несовместима с жизнью. Понятно, что высочайшие концентрации тяжёлой воды в ростовой среде могут вызвать ингибирование жизненно-важных функций роста и развития многих микробов [1]. Невзирая на нехороший биостатический эффект, оказываемый тяжёлой водой на клеточки, некие бактерии устойчивы к высочайшим концентрациям тяжёлой воды в среде [2], в то время как растительные клеточки могут нормально развиваться при концентрациях менее 50-75% тяжёлой воды [3], а клеточки животных менее 35% тяжёлой воды [4].
Каковой механизм клеточной адаптации к тяжёлой воде и могут ли клеточки быть удачно приспособлены к росту и биосинтезу на средах с наивысшими концентрациями тяжёлой воды? Для решения этих вопросов мы избрали для наших тестов на генном уровне маркированные штаммы-продуценты аминокислот, белков и нуклеозидов, относящиеся к разным таксономическим родам микробов [5-8]: факультативные метилотрофные бактерии Brevibacterium methylicum, облигатные метилотрофные бактерии Methylobacillus flagellatum, галофильные бактерии Halobacterium methylicum и бактерии Bacillus subtilis.
Результаты наших исследовательских работ изложены ниже:
Адаптация облигатных метилотрофных микробов M. flagellatum к тяжёлой воде. Для проведения адаптации к тяжёлой воде были применены представители 2-ух разных таксономических групп метилотрофных микробов, взятых из коллекции ГОСНИИ Генетики: лейцинпродуцирующий штамм облигатных метилотрофных микробов Methylobacilus flagellatum, ассимилирующий метанол по 2-кето-3-дезокси-6-фосфоглюконатальдолазному варианту рибулозо-5-монофосфатного (РМФ) цикла фиксации углерода [9] и фенилаланинпродуцирующий штамм факультативных метилотрофных микробов Brevibacterium methylicum, ассимилирующий метанол по РМФ-циклу фиксации углерода [10].
Для культивирования и адаптации данных штаммов метилотрофных микробов использовали малые среды М9, содержащие в качестве источников дейтерия тяжёлую воду и [U-2H]метанол. Зависимо от физиологической потребности того либо другого штамма микробов в углеродном субстрате использовали 0.5-2% концентрации метанола в ростовых средах. Так как ба штамма ауксотрофы по лейцину и изолейцину для компенсации ауксотрофности эти аминокислоты добавляли в ростовые среды в концентрациях 10 мг/л. В обыденных критериях культивирования на протонированных средах уровни скопления фенилаланина и лейцина в культуральных жидкостях штаммов-продуцентов достигали величины 0.8 и 1.0 г/л соответственно.
Для проведения адаптации был избран ступенчатый режим роста концентрации тяжёлой воды в ростовых средах в присутствии 0.5-1% метанола/[U-2H]метанола , потому что мы представили, что постепенное привыкание организма к дейтерию будет оказывать подходящий эффект на характеристики роста и общее самочувствие клеток (табл. 1). При всем этом штамм M. flagellatum нашел завышенную чувствительность к тяжёлой воде: ингибирование скорости роста микробов наблюдалось при концентрации тяжёлой воды в среде 74.5%, в то время как [U-2H]метанол не оказывал существенного воздействия на скорость роста культуры. Так, на среде, содержащей 74.5% тяжёлую воду выход микробной биомассы составил 29%, что в 3.4 раза ниже, чем в контрольных опытах, когда использовали обыденную воду и метанол (табл. 1, опыт 1), в то время как выход микробной биомассы на аква среде с 1% [U-2H]метанолом был снижен всего только в 1.2 раза. В связи с тем, что роста микробов на более высочайшей концентрации тяжёлой воды достигнуть не удалось в последующих опытах использовали колонии клеток M. flagellatum, приобретенные со среды, содержащей 74.5% 2H2О.
Адаптация факультативных метилотрофных микробов B. Methylicum к тяжёлой воде. Пробы адаптировать штамм B. methylicum к росту на тяжёлой воде при сохранении возможности к биосинтезу фенилаланина привели к хорошему результату. К данному штамму метилотрофных микробов был применён особый подход по адаптации, который заключался в серии из нескольких адаптационных пассажей начальной культуры на твёрдых агаризованных средах с 2% [U-2H]метанолом при ступенчатом увеличении концентрации тяжёлой воды в их (от 0 до 98% тяжёлой воды), как показано в табл. 2. При всем этом поочередно отбирали отдельные колонии, выросшие на средах, содержащих дейтерий. Потом их пересевали на среды с большей степенью дейтерированности, включая среду с 98% тяжёлой водой (степень выживаемости микробов на наибольшей тяжёловодородной среде составила менее 50%). За ходом адаптации наблюдали по изменениям длительности лаг-фазы, времени клеточной генерации и выходов микробной биомассы, также по наибольшему уровню скопления фенилаланина в культуральной воды (рис. 1).
Рис.1. Свойства бактериального роста B. Methylicum (выход биомассы, время генерации и секреция фенилаланина) на средах со ступенчато увеличивающейся концентрацией тежёлой воды, подходящим номерам тестов в таблице.
При росте клеток на обыкновенной воде длительность лаг-фазы не превосходила 20 ч, в то время как с повышением концентрации тяжёлой воды в ростовых средах до 98% длительность лаг-фазы увеличивалась до 60 часов (таблица 2, опыт 10). Отмечено, что продолжительность времени клеточной генерации с повышением концентрации тяжёлой воды в ростовых средах равномерно возрастает, достигая 4,9 часов на среде с 98% тяжёлой воды и 2% [U-2H]метанолом (табл. 2, опыт 10). В отличие от тяжёлой воды, [U-2H]метанол не вызывал существенного ингибирования роста и не оказывал воздействия на выходе микробной биомассы. Напротив, на очень концентрированной тяжёлой воде водой выход микробной биомассы был снижен в 3.3 раза по сопоставлению с контролем. Принципиально то, что выход микробной биомассы и уровень скопления фенилаланина в культуральной воды при росте приспособленного к тяжёлой воде мельчайшего организма в очень концентрированной тяжёлой воде меняются по сопоставлению с контрольными критериями на 13 и 5%, т. е. некординально (табл. 2, опыт 10’).
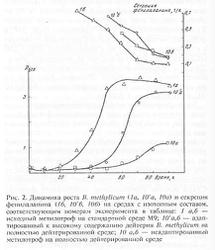
Рис.2. Динамики роста B. methylicum (1ф, 10’а, 10а) и секреция фенилаланина (1б, 10’б, 10б) на средах с обыкновенной и тяжёлой водой: 1 а,б – начальный метилотроф на обыкновенной воде; 10’а,б – приспособленный к тяжёлой воде мельчайший организм; 10 а,б – неадаптированный метилотроф на среде с тяжёлой водой
Увлекательным фактом является и то, что приспособленные к тяжёлой воде клеточки сохранили способность синтезировать и экзогенно продуцировать фенилаланин в ростовую среду. Причём общей особенностью биосинтеза фенилаланина в водно/тяжёловодородных средах было повышение его продукции на раней фазе экспоненциального роста B. methylicum, когда выход микробной биомассы был незначителен (рис. 2). Во всех опытах наблюдалось ингибирование биосинтеза фенилаланина на поздней фазе экспоненциального роста и понижение его концентрации в ростовых средах. Согласно данным по микроскопичному исследованию возрастающей популяции микробов, схожий нрав динамики секреции фенилаланина не коррелировал с высококачественными переменами ростовых черт культуры на разных стадиях роста, что служило доказательством морфологической однородности микробной популяции. Вероятнее всего, скопленный в процессе роста фенилаланин ингибировал ферменты собственного пути биосинтеза. Не считая того, не исключена возможность, что при ферментации без рН-статирования может происходить как оборотное перевоплощение секретируемого фенилаланина в интермедиаторные соединения его биосинтеза, так и ассимиляция фенилаланина клеточкой для обеспечения собственных метаболических потребностей, что отмечено в других работах [11, 12].
Данные по исследованию культуральной воды способом ТСХ проявили, что не считая фенилаланина штамм B. methylicum синтезирует и копит в культуральной воды (на уровне 5-6 ммоль) другие аминокислоты (аланин, валин, лейцин, изолейцин), присутствие которых также подтверждалось масс-спектрометрическим анализом метиловых эфиров их DNS-производных [13].
Потому что данный штамм метилотрофных микробов удалось адаптировать к предельной концентрации тяжёлой воды, исследование принципной способности использования гидролизатов его биомассы для культивирования других штаммов продуцентов представлялось очень животрепещущим. Следует выделить, что усваиваемость биомассы метилотрофов клеточками эукариот составляет 85-99%, а производительность метилотрофов, измеренная по уровню конверсии метилового спирта добивается 50% при всем этом учитывалось, что метилотрофные бактерии при росте на метаноле способны синтезировать огромное количество всеполноценных белков (до 55% от веса сухого вещества), также некое количество полисахаридов (до 10%), при этом эта способность сохраняется при росте на средах, содержащих тяжёлую воду и [U-2H]метанол. Для выделения этих соединений из (2Н)меченой биомассы метилотрофных микробов было нужно проводить её гидролиз. Для этого использовали два способа гидролиза биомассы — щадящий гидролиз оковём автоклавирования в 0.5 н. растворе дейтерохлорной кислоты (в тяжёлой воде) (30 мин, 08 ати) и исчерпающий гидролиз биомассы в 6 н.дейтерохлорной кислоте (в тяжёлой воде) (24 часа, 110 0С). В подготовительных опытах было показано, что по-первому варианту гидролиза биомассы реализуется еще большая питательность суспензии метилотрофных микробов по сопоставлению с гидролизом в 6 н. дейтерохлорной кислоте. Потому мы дали предпочтение этому способу проведения гидролиза биомассы.
Вследствие того, что применяемые в работе бактериальные штаммы были представлены их ауксотрофными по определенным аминокислотам формами, было нужно оценить сколько данных аминокислот содержится в гидролизатах биомассы и каковы уровни их дейтерированности. В гидролизате биомассы, приобретенной с тяжёловодородной среды было зафиксировано маленькое понижение содержания лейцина, изолейцина, глутаминовой кислоты, лизина и метионина по сопоставлению с биомассой, приобретенной на обыкновенной воде (табл. 3). Содержания аланина, аспарагиновой кислоты, треонина и аргинина в дейтерированном белке, напротив, малость превосходят контрольные характеристики, снятые в протонированной воде. Таким макаром, достигнутый итог в опытах по адаптации B. methylicum к тяжёлой воде, позволил использовать гидролизаты его (2Н)меченой биомассы, приобретенной в процессе многоступенчатой адаптации к тяжёлой воде в качестве ростовых субстратов для выкармливания бацилл Bacillus subtilis, также штамма галофильных микробов Halobacterium halobium. При всем этом, показателем, позволяющим возлагать на высшую эффективность включения дейтерия в продукты, синтезируемыми данными бактериальными штаммами, служит высочайший уровень дейтерированности аминокислот суммарного белка этих микробов, измеренный на метиловых эфирах DNS-производных аминокислот, кроме лейцина и метаболически схожих с ним аминокислот, сниженные уровни дейтерированности которых объясняются эффектом ауксотрофности данного метилотрофного штамма в лейцине (табл. 4).
Адаптация бацилл B. subtilis к тяжёлой воде. В последующих опытах была изучена способность к росту на тяжёлой воде бациллярного штамма B. subtilis, продуцента инозина. Рост данного штамма идеальнее всего происходил на ГС 1 среде, содержащей в качестве источника углерода глюкозу, а в качестве источника ростовых причин гидролизаты (2Н)меченой биомассы метилотрофных микробов B. methylicum.
Рис.3. Динамики роста Bacillus subtilis (1а,2а), скопления инозина (1б,2Б) и ассимиляции глюкозы (1в,2в) на средах с обыкновенной и тяжёлой водой: рядовая вода (1а,1б,1в); тяжёлая вода (2а,2б,2в)
Данный штамм удалось адаптировать к тяжёлой воде оковём рассева на твёрдую агаризованную среду ГС 1 с 99.9% тяжёлой воды. Он сходу нашел обычный рост на тяжёлой воде. При культивировании приспособленного B. subtilis на водянистой ГС 1 среде, уровень скопления инозина в культуральной воды понижается по-сравнению с начальным штаммом. К примеру, при росте начального штамма B. subtilis на среде, содержащей обыденную воду и протонированную биомассу уровень скопления инозина в культуральной воды достигал величины 17 г/л после 5 суток культивирования (рис. 3). Совместно с тем уровень скопления инозина на ГС 1 среде, был снижен в 4.4 раза по сопоставлению с начальным штаммом на протонированной среде. Сниженный уровень продукции инозина на в этих критериях коррелирует со степенью конверсии глюкозы, которая на тяжёлой воде ассимилировалась не стопроцентно, о чём свидетельствовали значимые количества скопленной в культуральной воды глюкозы после ферментации.
Потому было любопытно оценить содержание глюкозы в гидролизатах биомассы B. subtilis. В состав гидролизатов внутриклеточных сахаров данного штамма входят глюкоза, фруктоза, рамноза, арабиноза, мальтоза и сахароза (табл. 5). Принципиально, что содержание глюкозы в образчике, приобретенном с тяжёлой воды добивается 21.4%, т. е. существенно выше, чем для других сахаров. Содержания других сахаров в анализируемых образчиках с тяжёлой водой значительно не отличаются от таких для обыкновенной воды, кроме сахарозы, которая в дейтерированном образчике не детектируется (табл. 5).
Адаптация солелюбивых микробов H. halobium к тяжёлой воде. В случае с H. halobium адаптацию проводили как на агаре, содержащим 99.9% тяжёлую воду с добавлением гидролизатов (2Н)меченой биомассы B. methylicum, оковём рассева штамма до отдельных колоний, так и на водянистой ГС 2 среде. В обыденных для этой культуры критериях культивирования (37 0С, на свету) в клеточках синтезировался фиолетовый пигмент по всем чертам не отличающийся от нативного белка бактериородопсина.
Проведённые нами исследования свидетельствуют, что способность к адаптации к тяжёлой воде у различных родов и видов микробов разная и может разнообразить на примере метилотрофных микробов в границах даже одной таксономической группы. Из этого можно заключить, что адаптация к тяжёлой воде определяется как таксономической спецификой микрооорганизмов, так и особенностями их метаболизма, функционированием разных путей ассимиляции субстратов, также эволюционной нисшей, которую занимает исследуемый объект. При всем этом чем ниже уровень эволюционного развития организма, тем лучше он адаптируется к присутствию дейтерия в среде. Так, из изученных объектов самыми простыми в эволюционном плане являются галофильные бактерии, относящиеся к археобактериям, фактически не нуждающие в адаптации к тяжёлой воде, чего нельзя сказать о метилотрофных микробах, которые сложнее приспосабливаются к тяжёлой воде. Для всех изученных микробов рост на тяжёлой воде сопровождался понижением ростовых черт также уровня продукции секретируемых БАС.
Приобретенные для изученных микробов данные в целом подтверждают устойчивое представление о том, что адаптация к тяжёлой воде является фенотипическим явлением, так как приспособленные к тяжеленной воде клеточки ворачиваются к нормальному росту и биосинтезу в протонированных средах после некого лаг-периода. По-видимому, метаболизм приспособленных клеток не претерпевает существенных конфигураций в тяжёлой воде. В то же время эффект обратимости роста на водно/тяжёловодородных средах на теоретическом уровне не исключает способности того, что этот признак размеренно сохраняется при росте в воде, но маскируется при переносе клеток на тяжёлую воду. Но, тут следует отметить, что для проведения адаптации играет немаловажную роль состав среды культивирования. При всем этом не исключено, что при проведении адаптации на малых средах, содержащих тяжёлую воду образуются формы микробов, ауксотрофные по определенным ростовым факторам, к примеру аминокислотам, и вследствие этого бактериальный рост ингибируется. Адаптация к тяжёлой воде происходит идеальнее всего конкретно на всеохватывающих средах, содержащих широкий набор ростовых причин и аминокислот, компенсирующих потребность микробов в этих соединениях.
Можно представить, что клеточка реализует лабильные адаптивные механизмы, которые содействуют многофункциональной реорганизации работы жизненно-важных систем в тяжёлой воде. Так, к примеру, нормальному биосинтезу и функционированию в тяжёлой воде таких на биологическом уровне активных соединений, как нуклеиновые кислоты и белки содействует поддержание их структуры средством формирования водородных (дейтериевых) связей в молекулах. Связи, сформированные атомами дейтерия различаются по прочности и энергии от подобных водородных связей. Различия в нуклеарной массе атома водорода и дейтерия косвенно могут служить предпосылкой различий в синтезах нуклеиновых кислот, которые могут приводить в свою очередь к структурным различиям и, как следует, к многофункциональным изменениям в клеточке. Скорее всего, что ферментативные функции и структура синтезируемых белков также меняются при росте клеток на тяжёлой воде, что может отразиться на процессах метаболизма и деления клеточки. Некие исследователи докладывают, что после оборотного изотопного (1Н-2H)-обмена ферменты не прекращают собственной функции, но конфигурации в итоге изотопного замещения за счет первичного и вторичного изотопных эффектов, также действие тяжёлой воды как растворителя (большая структурированность и вязкость по сопоставлению с обыкновенной водой) приводили к изменению скоростей и специфики ферментативных реакций в тяжёлой воде [14-15].
Структурно-динамические характеристики клеточной мембраны, которые в большинстве зависят от высококачественного и количественного состава липидов, также могут изменяться в присутствии тяжёлой воды. Так, сравнительный анализ липидного состава дейтерированных клеток B. subtilis, приобретенных при росте на тяжёлой воде показал различия в количественном составе мембранных липидов по сопоставлению с обыкновенной водой (рис. 4). Броско, что в образчике приобретенном с тяжёлой воды соединения, имеющие времена удерживания — 33.38; 33.74 и 33.2 мин не детектируются (рис. 4 б). Приобретенный итог, по видимому, разъясняется тем, что клеточная мембрана является одной из первых органелл клеточки, которая испытывает воздействие тяжёлой воды, и тем компенсирует реалогические характеристики мембраны (вязкость, текучесть, структурированность) конфигурацией количественного состава липидов.

Рис.4. Липидные профили микробов B. subtilis, приобретенные на обыкновенной (а) и тяжёлой воде (б): Анализ проводили на хроматографе Beckman Gold Systems (США); сорбент: Ultrasphere ODS 5 мкм; 4.6×250 мм; элюент: линейный градиент 5 мМ бисульфат калия-ацетонитрил; 100 об.% в течении 50 мин; скорость элюции: 0.5 мл/мин; детекция при длине волны 210 нм.
В общих чертах, при попадании клеточки в дейтерированную среду из неё не только лишь исчезает протонированная вода за счет реакции обмена вода-тяжёлая вода, да и происходит очень резвый изотопный (1Н-2H)-обмен в гидроксильных, карбоксильных, сульфгидрильных и аминогруппах всех органических соединений, включая нуклеиновые кислоты, липиды, белки и сахара. Понятно, что в этих критериях только С-Н связь не подвергается изотопному обмену и вследствие этого только соединения со связями типа С-2H могут синтезироваться de novo [16].
Не считая вышеобозначенных эффектов, вероятное изменение соотношения главных метаболитов в процессе адаптации к тяжеленной воде также может плохо сказываться на рост клеточки.
Также не исключено, что эффекты, наблюдаемые при адаптации к тяжёлой воде связаны с образованием в тяжёлой воде конформаций молекул с другими структурно-динамическими качествами, чем конформаций, образованных с ролью водорода, и потому имеющих другую активность и био характеристики. Так, по теории абсолютных скоростей разрыв С2H-связей может происходить резвее, чем СH-связей, подвижность иона 2H+ меньше, чем подвижность Н+, константа ионизации тяжёлой воды несколько меньше константы ионизации обыкновенной воды [17].
Суммируя приобретенные данные, можно прийти к выводу, что чувствительности разных клеточных систем к тяжёлой воде отличны. С физиологической точки зрения, более чувствительными к подмене Н+ на 2H+ возможно окажутся аппарат биосинтеза макромолекул и дыхательная цепь, т. е., конкретно те клеточные системы, которые употребляют высшую подвижность протонов и высшую скорость разрыва водородных связей.
Нам представляется выбор микробов в качестве модельных объектов для данных исследовательских работ более целесообразным, потому что прокариоты как организмы, стоящие на более низких ступенях развития живого, более лабильны в генетическом нюансе и тем резвее реагируют и адаптируются к изменчивым факторам среды. В заключение следует выделить, что для того чтоб сделать более определенные выводы о природе и механизме адаптации клеток к тяжеленной воде, нужны новые экспериментальные данные по физиологии и биохимии приспособленных клеток.
Материалы и способы:
Объектами исследования служили на генном уровне маркированные штаммы-продуценты аминокислот, белков и нуклеозидов, приобретенные из Всероссийской коллекции промышленных микробов (ВКПМ) Муниципального научно-исследовательского института генетики и селекции промышленных микробов:
1. Brevibacterium methylicum ВКПМ В 5652, лейцинзависимый штамм факультативных метилотрофных микробов, продуцент фенилаланина.
2. Methylobacillus flagellatum КТ, изолейцинзависимый штамм облигатных метилотрофных микробов, продуцент лейцина.
3. Bacillus subtilis В-3157, полиауксотрофный по гистидину, тирозину, аденину и урацилу штамм грамотрицательных микробов, продуцент инозина.
4. Halobacterium halobium ЕТ 1001, пигментсодержащий штамм галофильных микробов, способный синтезировать бактериородопсин.
Для изготовления сред и адаптации микробов использовали тяжёлую воду (99.9% 2H), и дейтерохлористую кислоту (95.5% 2H) и [U2Н]метанол (97.5% 2H), приобретенные из Русского научно-исследовательского центра “Изотоп” (Санкт-Петербург, РФ). По необходимости тяжёлую воду очищали от вредных примесей, перегоняя её над перманганатом калия [18].
Стартовым материалом для культивирования галофильных микробов и бацилл служила (2Н)меченая биомасса метилотрофных микробов, приобретенная в критериях многостадийной адаптации на жестких агаризованных средах (2% агар) с 2% [U2Н]метанолом, содержащих ступенчато увеличивающиеся концентрации тяжёлой воды (от 0 до 98% тяжёлой воды). Полученную таким макаром (2Н)меченую биомассу B. methylicum (выход составил 100 г по мокроватому весу с 1 л. среды) автоклавировали в 0.5 н. растворе дейтерохлорной кислоты (в тяжёлой воде) (08 ати, 30 мин), нейтрализовали 0.1 н. КОН (рН 7.0) и использовали дальше в качестве источника ростовых причин для адаптации и культивирования бацилл и галофильных микробов.
При культивировании клеток микробов использовали последующие питательные среды (количества компонент приведены в г/л):
1. Малая среда М9, на базе разных концентраций тяжёлой воды (см. табл. 1 и табл. 2) и добавками 0.5-2% метанола (зависимо от физиологической потребности микробов) либо [U-2H]метанола: KH2PO4 3; Na2HPO4 6; NaCl 0.5; NH4Cl 1. Среду использовали для культивирования метилотрофных микробов.
2. Гидролизная среда 1 (ГС1) для культивирования бацилл (на базе 99.9% тяжёлой воды): глюкоза 120; (2Н)меченая биомасса B. methylicum 25; NH4NO3 30; MgSO4 x 7H2O 20; мел 20.
3. Гидролизная среда 2 (ГС2) для культивирования галофильных микробов (на базе 99.9% тяжёлой воды): NaCl 250; MgSO4 x 7H2O 20; KCl 2; CaCl2 x 6H2O 0.065; цитрат натрия 0.5; (2Н)меченая биомасса B. methylicum 20.
Культивирование метилотрофных микробов и бацилл проводили при 370 С в колбах Эрленмейера вместимостью 250 мл с заполнением средой до 50 мл в критериях насыщенной аэрации по методикам [5-8], используя в качестве источников дейтерия тяжёлую воду и [U-2H]метанол. В случае с галофильными микробами их культивирование проводили на тяжеловодородной среде при освещении лампами дневного света ЛБ-40. После 6-7 суток культивирования клеточки отделяли центрифугированием (10000 об/мин, 20 мин). В культуральных жидкостях анализировали секретируемые аминокислоты и нуклеозиды.
Для выделения фракции суммарных белков биомассы клеточки два раза промывали дистиллированной водой с следующим центрифугированием (10000 об/мин, 20 мин), выставляли ультразвуком при 22 кГц (3 x 15 мин) и центрифугировали. Липиды и пигменты экстрагировали консистенцией органических растворителей хлороформ-метанол-ацетон (2:1:1) по способу Блайя и Дайера [19]. Приобретенный осадок высушивали до неизменного веса (10-12 мг) и использовали его в качестве фракции суммарных белков биомассы.
Суммарные белки биомассы гидролизовали в запаянных стеклянных ампулах в 50-ти кратном излишке 6 н. дейтерохлористой кислоты (в тяжёлой воде). Ампулы выдерживали при 1100 в течение 24 ч. После чего обскурантистскую массу суспендировали в жаркой дистиллированной воде, фильтровали. Гидролизат упаривали в роторном испарителе при 400 С. Остатки дейтеросоляной кислоты удаляли методом выдерживания в эксикаторе над жестким NaOH.
Для проведения гидролиза внутриклеточных полисахаридов 50 мг сухой делипидизованной биомассы помещали в круглодонную пробирку вмесимостью 250 мл, добавляли 50 мл дистиллированной воды и 1.6 мл 25% дейтеросерной кислоты и кипятили с оборотным водяным холодильником в течении 90 мин. По охлаждении обскурантистскую смесь суспендировали в одном объёме жаркой дистиллированной воды и нейтрализовали 2 н. веществом Ba(ОН)2 до рН 7.0. Выпавший осадок сульфата бария отделяли центрифугированием (15000 об/мин, 5 мин), супернатант декантировали и упаривали в роторном испарителе при 400 С.
Рост микробов оценивали по возможности к образованию отдельных колоний на поверхности твёрдых агаризованных сред, также по величине оптической плотности суспензии клеток, измеренной на спектрофотометре Beckman-DU6 (США) при 540 нм в кварцевой кювете с длиной оптического пути 10 мм.
Тонкослойную хроматографию (ТСХ) проводили на пластинках Silufol UV-254 (Чехо-Словакия) либо на пластинках с закреплённым слоем селикагеля компании Merck (Германия) в системах растворителей: изопропанол-аммиак, (7:3) (A) для аминокислот и н-бутанол-уксусная кислота-вода, (2:1:1), (Б) для инозина.
Определение содержания глюкозы в культуральной воды проводили глюкозооксидазным способом [20].
Секретируемые фенилаланин и инозин определяли на приборе Beckman DU-6 (США). Фенилаланин определяли при 540 нм в образчиках культуральной воды, объёмом 10 мкл после обработки препаратов культуральной воды нингидрином, инозин — при 249 нм в образчиках культуральной воды, объёмом 20 мкл.
Аминокислотный анализ гидролизатов суммарных белков биомассы проводили на приборе Biotronic LC 5001 (ФРГ); 230 x 3,2 мм; рабочее давление 50-60 атм; скорость подачи натрийцитратного буфера 18.5; нингидрина 9.25 мл/ч; детекция при 570 нм и 440 нм (для пролина).
Анализ углеводов производили на жидкостном хроматографе Knauer (ФРГ), снабженным насосом Gilson (ФРГ) и рефрактометром Waters К 401 (ФРГ); недвижная фаза: Separon NH2, 10 мкм; 10 x 250 мм; подвижная фаза: ацетонитрил-вода, (75:25); скорость подачи: 0.6 мл/мин.
Липиды анализировали на хроматографе Beckman Gold System (США), снабжённым насосом Model 166 (США) и сенсором Model 126 (США); недвижная фаза: Ultrasphere ODS 5 мкм; 4.6 x 250 мм; подвижная фаза: линейный градиент 5 мМ KH2PO4-ацетонитрил; 100% в течении 50 мин; скорость подачи: 0.5 мл/мин; детекция при 210 нм.
Уровни включения дейтерия в аминокислоты белковых гидролизатов определяли способом масс-спектрометрии электрического удара в виде метиловых эфиров N-диметиламинонафталин-5-сульфонильных (дансильных) производных аминокислот на приборе MB-80A (Hitachi, Япония) при ионизирующем напряжении 70 эВ.
Перечень литературы:
1. Crespi H. L. Biosynthesis and uses of per-deuterated proteins. in: Synt. and Appl. of Isot. Label. Compd. // Ed. R. R. Muccino. — Elsevier. — Amsterdam, 1986 — P. 111-112.
2. Katz J, Crespi H.L. // Pure Appl. Chem. — 1972. — V.32. — P. 221-250.
3. Daboll H. F., Crespi H. L., Katz J. J. // Biotechnology and Bioengineering. — 1962. — V. 4. — P. 281-297.
4. Crespy H. L. Stable Isotopes in the Life Sciences. — International atomic energy agency. — Vienna. — 1977. — P. 111-121.
5. Мосин О. В., Карнаухова Е. Н., Пшеничникова А. Б., Складнев Д. А., Акимова О. Л. // Биотехнология. — 1993. — N 9. — С. 16-20.
6. Мосин О. В., Складнев Д. А., Егорова Т. А., Юркевич А. М., Швец В. И. // Биотехнология. — 1996. — N 3. — С. 3-12.
7. Мосин О. В., Складнев Д. А., Егорова Т. А., Юркевич А. М., Швец В. И. // Биотехнология. — 1996. — N 4. — С. 27-35.
8. Складнев Д. А., Мосин О. В., Егорова Т. А., Ерёмин С. В., Швец В. И. // Биотехнология. — 1996. — N 5. — С. 25-34.
9. Kletsova L. V., Chibisova E. S., Tsygankov Y. D. // Arch. Microbiol. — 1988. — V. 149. — P. 441-446.
10. Nesvera J., Patek M., Hochmannova J., Chibisova E., Serebrijski I., Tsygankov Y., Netrusov A. // Appl. Microb. Biotechnol. — 1991. — V. 35. — P. 777-780.
11. Ворошилова Э. Б., Гусятинер М. М., Жданова Н. И. // Биотехнология. — 1989. — N 2. — С. 137-141.
12. Максимова Н. П., Олехнович И. Н. Регуляция биосинтеза ароматичных аминокислот у метилотрофных микробов: Биохимия и физиология метилотрофов. — Пущино, 1987. — С. 77-85.
13. Мосин О. В., Складнев Д. А., Егорова Т. А., Швец В. И. // Биоорганическая химия. — 1996. — Т. 22. — N 10-11. — С. 856-869.
14. Barksdale A. D., Rosenberg A. // Methods Biochem. Anal. — 1982. — V. 28. — P. 1-25.
15. Tuchsen E., Woodward C. K. // J. Mol. Biol. — 1985. — V. 185. — P. 421-430.
16. Perrin C. L., Arrhenius G. M. L. // J. Am. Chem. Soc. — 1982. — V. 104. — P. 6693-6699.
17. Covington A. K., Robinson R. A., Bates R. G. // J. Phys. Chem. — 1966. — V. 70. — P. 3820-3829
18. Кейл Б. Лабораторная техника органической химии. — М.: Мир, 1966. — С. 504.
19. Bligh E.G., Dyer W.J. // Can. J. Biochem. Physiol. — 1959. — V. 37. — N. 8. — P. 911-918.
20. Полюдек-Фабини Р., Бейрих Т. // Органический анализ. — Л. Химия. — 1981. — С. 515-516.