 Внедрение ауксотрофных мутантов микробов для получения изотопномеченных аминокислот и белков
Внедрение ауксотрофных мутантов микробов для получения изотопномеченных аминокислот и белков
Внедрение ауксотрофных мутантов микробов для получения изотопномеченных аминокислот и белков
Внедрение ауксотрофных по определённым аминокислотам форм микробов для биосинтеза изотопномеченых аминокислот и белков стало так пользующимся популярностью в биотехнологии, что сейчас его следует рассматривать как отдельное направление. Селективность мечения белков достигается в итоге прибавления в ростовую среду меченого аналога соответственной аминокислоты либо её предшественника, по которым штамм ауксотрофен и которые, вследствие этого, конкретно либо через de novo биосинтетический цикл предшественников подменяют в белке нативную аминокислоту. Аналогичный принцип может применяться и при получении изотопномеченых аналогов аминокислот. При всем этом ауксотрофные штаммы могут относиться к разным таксономическим группам микробов, включая метаногенные и метилотрофные бактерии, биотехнологический потенциал которых для получения изотопномеченых аминокислот в текущее время общепризнан. Так, метаногенные бактерии, относящиеся к группе облигатных анаэробов, которые получают энергию за счет ассимиляции газовой консистенции (H2-CO2) [88, 89], в большинстве случаев употребляют для получения [13C]аминокислот. Причём эффективности мечения аминокислот 13С достигают за счёт получения и использования ацетатзависимых мутантов метаногенных микробов, неспособных синтезировать ацетил-СоА из СО2 и вследствие этого для роста которых нужен экзогенный ацетат [90].
 Потому выкармливание этих микробов проводят на ростовых средах, содержащих вместе с (H2-CO2) добавки ацетата, которые могут заменяться их [13С]аналогами. Обычно, при росте этих метанотрофов на средах с (H2-13CO2) и [13C]ацетатом удаётся достигнуть униформного нрава включения 13С по углеродным скелетам в молекулах аминокислот, также резкого уменьшения уровня включения экзогенного 13СО2 в конечный продукт ассимиляции углерода — метан [91]. В этом случае удается практически стопроцентно избежать процесса разбавления метки в молекулах синтезируемых [13C]аминокислот. Селективного замещения молекул аминокислот изотопом 13С можно достигнуть за счёт использования ростовых сред, содержащих немеченую смесь (Н2-СО2) и [13C]ацетат или 13СО2 в составе консистенции (Н2-13СО2) и немеченый ацетат [92]. При всем этом вследствие высочайшей цены 13СО2 и неудобств, связанных с её компрессией, получение [13C]аминокислот в большинстве случаев производят по первому варианту, т. е. с внедрением (Н2-СО2) и [13C]ацетата. Но, как было отмечено в работах [93, 94], этим ацетатассимилирующим метаногенам, к примеру, Methanospirillum hungatei GP1 требуются значимые концентрации ацетата для рационального роста. Вследствие этого главным недочетом использования этих микробов является значимый расход изотопной метки. При биотехнологическом получении изотопномеченых аминокислот нужно учесть пути их биосинтеза в клеточке, которые для метаногенных микробов хотя и являются характеристичными, но несколько отличаются от узнаваемых для E. coli. Данные по биосинтезу [13C]аминокислот, приобретенных при выращивании ауксотрофной по ацетату бактерии M. hungatei GP1 в среде, содержащей (H2-CO2) и [1,213C]ацетат в качестве источников углерода и энергии, приведены ниже.
Потому выкармливание этих микробов проводят на ростовых средах, содержащих вместе с (H2-CO2) добавки ацетата, которые могут заменяться их [13С]аналогами. Обычно, при росте этих метанотрофов на средах с (H2-13CO2) и [13C]ацетатом удаётся достигнуть униформного нрава включения 13С по углеродным скелетам в молекулах аминокислот, также резкого уменьшения уровня включения экзогенного 13СО2 в конечный продукт ассимиляции углерода — метан [91]. В этом случае удается практически стопроцентно избежать процесса разбавления метки в молекулах синтезируемых [13C]аминокислот. Селективного замещения молекул аминокислот изотопом 13С можно достигнуть за счёт использования ростовых сред, содержащих немеченую смесь (Н2-СО2) и [13C]ацетат или 13СО2 в составе консистенции (Н2-13СО2) и немеченый ацетат [92]. При всем этом вследствие высочайшей цены 13СО2 и неудобств, связанных с её компрессией, получение [13C]аминокислот в большинстве случаев производят по первому варианту, т. е. с внедрением (Н2-СО2) и [13C]ацетата. Но, как было отмечено в работах [93, 94], этим ацетатассимилирующим метаногенам, к примеру, Methanospirillum hungatei GP1 требуются значимые концентрации ацетата для рационального роста. Вследствие этого главным недочетом использования этих микробов является значимый расход изотопной метки. При биотехнологическом получении изотопномеченых аминокислот нужно учесть пути их биосинтеза в клеточке, которые для метаногенных микробов хотя и являются характеристичными, но несколько отличаются от узнаваемых для E. coli. Данные по биосинтезу [13C]аминокислот, приобретенных при выращивании ауксотрофной по ацетату бактерии M. hungatei GP1 в среде, содержащей (H2-CO2) и [1,213C]ацетат в качестве источников углерода и энергии, приведены ниже.
[13C] Аланин. Включение углерода 13С в молекулу аланина происходило за счет реакции карбоксилирования ацетил-СоА до пирувата. Таковой путь биосинтеза был продемонстрирован для других таксономических родов и видов метаногенных микробов [95].
[13C] Серин и [13C] глицин. Нрав рассредотачивания изотопа 13C в молекулах серина и глицина был объяснён частичным фосфорилированинем пирувата до фосфопирувата и образованием 3-фосфоенолпирувата по гликогенному пути ассимиляции углерода. Доказательством этому служат значимые уровни активности ферментов — фосфоенолпируватсинтетазы, енолазы и 2-фосфоглицератмутазы, которые были обнаружены в клеточных экстрактах других метаногенов, к примеру, Methanobacterium thermoautotrophicum [96].
[13C] Аспарагиновая кислота, [13C] треонин и [13C] метионин. Присоединение 13C-метки по атому углерода ?-карбоксильной группы аспартата, происходящего из C1-ацетата и по ?-углеродному атому С2-ацетата и включение изотопа 13С в карбоксильные группы аминокислот из СО2, свидетельствовало о том, что биосинтез аспартата в этой бактерии происходил через цикл трикарбоновых кислот в итоге ферментативного карбоксилирования пирувата до оксалоацетата. Рассредотачивание метки в треонине и метионине происходило в согласовании с методом биосинтеза этих аминокислот из аспартата. Атом углерода в метильной группе молекулы метионина происходил из СО2.
[13C] Лизин. Рассредотачивание метки 13С в молекуле лизина свидетельствовало о том, что лизин синтезировался из пирувата и аспартата по обычному для микробов диаминопимелиновому пути [97].
[13C]Глутаминовая кислота, [13C]аргинин и [13C]пролин. В молекуле глутаминовой кислоты изотопная метка детектировалась в С? и C? положениях углеродного скелета молекулы. Атомы углерода при карбоксильной СООНгруппе молекулы глутаминовой кислоты и в ?-положении происходили из СО2. Этот итог свидетельствовал о том, что цикл трикарбоновых кислот приводил к образованию ?-кетоглутарата. Рассредотачивание 13C-метки в молекулах аргинина и пролина аналогично таковому в глутаминовой кислоте.
[13C] Лейцин, [13C] валин и [13C] изолейцин. Нрав изотопного включения 13С в молекулы лейцина и валина свидетельствовал об их образовании из ?-ацетолактата, в то время как биосинтез изолейцина отличался от ожидаемого пути биосинтеза этой аминокислоты из треонина. В клеточках M. hungatei изолейцин создавался из ацетата. Аналогичный путь биосинтеза изолейцина был найден у спирохеты [98], у лейцинассимилирующего мутанта Serratia marcescens [99], и у мутанта Saccharomyces cerevisiae, у которого дефектен ген треониндезаминазы [100].
[13C] Фенилаланин и [13C] тирозин. Меченые позиции углерода в молекулах фенилаланина и тирозина стопроцентно совпадали с обычным для микробов методом биосинтеза этих аминокислот из шикимовой и хоризмовой кислот [101].
[13C] Гистидин. Атом углерода в положении C? имидазольного кольца гистидина происходил из СО2. Углеродный атом в положении С? имидазольного кольца гистидина был замещён на изотоп 13С с ролью С2ацетата.
Табл. 1
Характеристики роста неких применяемых в биотехнологии штаммов метилотрофных микробов
Штаммы микробов
Молярный выход биомассы, г/моль метанола
Удельная скорость роста, ч-1
Эффективность конверсии углерода метанола, %
Количество потребленного азота, %
Рибулозо-5-монофосфатный путь ассимиляции углерода
Pseudomonas C1
17,3
0,49
67,5
13,2
Pseudomonas methanolica
17,0
0,63
66,5
11,0
Methylomonas methanolica
15,7
0,52
62,0
11,7
Сериновый путь ассимиляции углерода
Pseudomonas 1
12,1
0,176
47,5
11,37
Pseudomonas 135
12,1
0,14
47,5
11,37
Pseudomonas AM1
9,8
0,093
37,6
11,20
Pseudomonas M27
13,1
0,108
51,0
9,40
Pseudomonas roseus
13,1
0,15
51,0
10,60
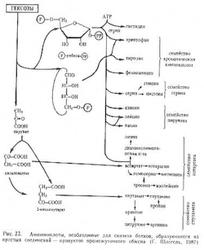
Другими многообещающими источниками изотопномеченых аминокислот и белков признаны метилотрофные мельчайшие организмы, которые в таксономическом нюансе представлены грамположительными, грамотрицательными микробами и дрожжами, энтузиазм к которым в текущее время все растет благодаря разработке новых технологий хим синтеза метанола [102]. Эти бактерии завлекают внимание исследователей сначала как дешевенькие источники микробного белка и аминокислот [103, 104]. Познание путей бактериального метаболизма позволяет производить направленное введение изотопной метки в молекулы аминокислот. Как понятно, метилотрофные бактерии окисляют метанол с внедрением фермента — метанолдегидрогеназы, следующие окислительные реакции катализируют формальдегиди формиатдегидрогеназа [105-108]. Только потом продукт окисления метанола в виде метаналя фиксируется клеточкой одним из 2-ух путей ассимиляции углерода: рибулозо-5-монофосфатным и сериновым [109, 110]. Главные характеристики роста неких применяемых в биотехнологии штаммов метилотрофных микробов представлены в таблице 1.
Ауксотрофные штаммы метилотрофных микробов начали отлично использовать для получения [2H]и [13C]аминокислот. Для этих целей перспективно производить биологическую конверсию дешёвых низкомолекулярных меченых субстратов — (13С)метанола, (2Н)метанола и 2Н2O в дорогостоящие меченые БАС в клеточках метилотрофов [111-113]. Обычным подходом при всем этом остаётся выкармливание соответственных штаммов-продуцентов аминокислот, устойчивых к росту на средах, содержащих постоянные изотопы водорода, углерода, азота и др. В работах [114, 115] сообщается о получении [13C]аминокислот (уровни включения размеренных изотопов в молекулах варьируют от 30% для L-[13C]лейцина до 90% для L-[13C]фенилаланина) за счёт использования ауксотрофных по L-изолейцину микробов Methylobacillus flagellatum.
Заслуживает упоминания то, что (13С)метанол в отличие от 2Н2О не оказывает существенного биостатического эффекта на ростовые и биосинтетические свойства метилотрофов [116], потому данный подход можно отлично использовать для введения в молекулы синтезируемых БАС двойной изотопной метки (к примеру, введение изотопа 13С в молекулы на фоне наибольших концентраций 2Н2О в ростовых средах). В работе [117] были получены [2H]и [13С]аминокислоты с различными уровнями изотопной обогащённости при росте ауксотрофного по L-лейцину штамма факультативных метилотрофных микробов Brevibacterium methylicum и ауксотрофного по L-изолейцину штамма облигатных метилотрофных микробов Methylobacillus flagellatum на малых средах с (13С)метанолом, (2Н)метанолом и 2Н2О. [13C]и [2Н]аминокислоты различного уровня изотопной замещённости выделяли как из культуральных жидкостей, приобретенных после выкармливания микробов на средах с надлежащими изотопномечеными субстратами, так из гидролизатов белков биомассы. Биосинтетически приобретенные [2H]и [13С]аминокислоты представляли собой консистенции, в каких присутствовали изотопнозамещённые формы молекул, различающиеся количеством атомов водорода и углерода, замещённых на 2Н и 13С. При всем этом рассредотачивание зависело как от общего включения изотопа в молекулу, так и от метода их получения. Данные по суммарным уровням включения размеренных изотопов в молекулы секретируемых аминокислот и аминокислотные остатки суммарных белков биомассы B. methylicum и M. flagellatum представлены в таблице 2. Эти исследования проявили, что в критериях ауксотрофности по лейцину уровень изотопного обогащения лейцина, также метаболически связанных с ним аминокислот малость ниже, чем для других аминокислот, возможно, за счёт сохранения минорных путей метаболизма, связанных с биосинтезом данных аминокислот de novo. Так, при выращивании B. methylicum на среде, содержащей 98% 2Н2О и немеченый L-лейцин, уровни включения дейтерия в личные аминокислоты культуральной воды составили 51% для лейцина/изолейцина, 58,8% для валина, в то время как уровни изотопного включения для аланина составили 77,5%, для фенилаланина -75% (табл. 2).
Табл. 2
Суммарные уровни включения размеренных изотопов в молекулы секретируемых аминокислот и аминокислотные остатки суммарных белков биомассы B. methylicum* и M. flagellatum**.
*Данные по включению дейтерия в молекулы аминокислот приведены для B. methylicum при росте на средах, содержащих 2% CH3OH и 24,5; 49,0; 73,5; 98,0% 2Н2О
**Данные по включению 13С приведены для M. flagellatum при росте на среде, содержащей обыденную воду и 1% 13СН3ОН.
#Термином КЖ обозначены культуральные воды, приобретенные после отделения клеток из ростовых сред
Подобная корреляция наблюдалась и в аминокислотах белковых гидролизатов. Уровни включения 2Н и 13С в метаболически связанных аминокислотах в границах схожих концентраций меченых субстратов, нашли определённую коррелляцию: уровни изотопного включения для валина и лейцина (семейство пирувата), фенилаланина и тирозина (семейство ароматичных аминокислот) коррелировали (табл. 2). Уровни изотопного включения для глицина и серина (семейство серина), аспарагиновой кислоты и лизина (семейство аспарагина) также имели близкие величины. Принципиальным результатом являются высочайшие уровни включения размеренных изотопов 2Н и 13С в молекулы приобретенных аминокислот. В текущее время исследования по исследованию биотехнологического потенциала метилотрофных микробов для направленного синтеза изотопномеченых аминокислот и других БАС длятся.