 Вода без воздуха (газов)
Вода без воздуха (газов)
Вода без воздуха (газов)
Вопрос:
Здрасти. Меня интересует последующий вопрос. Может быть ли в домашних критериях освободить воду от воздуха (газов)? И может «чистая вода» (Н2О), без других молекул, а, а именно, без воздуха (газов) кристаллизироваться (лед)? Спасибо заблаговременно за ответ и замечательно-познавательный веб-сайт :). Александр
Ответ:
Здрасти, почетаемый Александр. Огромное спасибо за Ваш энтузиазм к нашему веб-сайту. Как понятно из химии, существование полностью незапятнанных веществ нереально в природе – всякое вещество непременно содержит примеси. Если имеющиеся в веществе примеси в границах точности описания системы не оказывают воздействия на изучаемые характеристики, можно считать систему однокомпонентной; в неприятном случае гомогенную систему считают веществом.
Раствор – гомогенная система, состоящая из 2-ух либо более компонент, состав которой может безпрерывно изменяться в неких границах без скачкообразного конфигурации её параметров.
Раствор может иметь хоть какое агрегатное состояние; соответственно их делят на твердые, водянистые и газообразные (последние обычно именуют газовыми растворами). Даже обычный воздух можно считать веществом газообразных кислорода (21 объёмных %), азота (78 больших %) и углекислого газа (1 объёмный %).
Обычно составляющие раствора делят на растворитель и растворенное вещество. Обычно, растворителем считают компонент, присутствующий в растворе в преобладающем количестве или компонент, кристаллизующийся первым при охлаждении раствора; если одним из компонент раствора является жидкое в чистом виде вещество, а остальными – твердые вещества или газы, то растворителем считают жидкость. С термодинамической точки зрения это деление компонент раствора не имеет смысла и носит потому условный нрав.
Одной из важных черт раствора является растворимость. Раствори?мость — способность вещества создавать с другими субстанциями смеси, в каких вещество находится в виде отдельных атомов, ионов, молекул либо частиц. Растворимость выражается концентрацией растворённого вещества в его растворе или в процентах, или в весовых либо объёмных единицах, отнесённых к 100 г либо 100 см? (мл) растворителя (г/100 г либо см?/100 см?).
Молярная концентрация С – число молей ?В растворенного вещества в одном литре раствора.
Обычная концентрация N – число молей эквивалентов растворенного вещества (равное числу молей ?В, умноженному на фактор эквивалентности f) в одном литре раствора.
Моляльная концентрация m – число молей растворенного вещества в одном килограмме растворителя.
Процентная концентрация ? – число граммов растворенного вещества в 100 граммах раствора.
 Еще одним методом выражения концентрации является мольная толика X – отношение числа молей данного компонента к общему числу молей всех компонент в системе.
Еще одним методом выражения концентрации является мольная толика X – отношение числа молей данного компонента к общему числу молей всех компонент в системе.
Концентрация компонента в растворе может изменяться от нуля до некого наибольшего значения, именуемого растворимостью компонента.
Величина растворимости охарактеризовывает равновесие меж 2-мя фазами, потому на неё оказывают влияние все причины, смещающие это равновесие (в согласовании с принципом Ле Шателье – Брауна).
Образование раствора является сложным физико-химическим процессом. Процесс растворения всегда сопровождается повышением энтропии системы; при образовании смесей нередко имеет место выделение или поглощение теплоты. Теория смесей должна разъяснять все эти явления. Исторически сложились два подхода к образованию смесей – физическая теория, базы которой были заложены в XIX веке, и хим, основателем которой был Д.И. Менделеев.
Физическая теория смесей рассматривает процесс растворения как рассредотачивание частиц растворенного вещества меж частичками растворителя, предполагая отсутствие какого-нибудь взаимодействия меж ними. Единственной движущей силой такового процесса является повышение энтропии системы ?S; какие-либо термические либо большие эффекты при растворении отсутствуют (?Н = 0, ?V = 0; такие смеси принято именовать безупречными).
Хим теория рассматривает процесс растворения как образование консистенции неуравновешенных хим соединений переменного состава, сопровождающееся термическим эффектом и конфигурацией объема системы (контракцией), что нередко приводит к резкому изменению параметров растворенного. Современная термодинамика смесей базирована на синтезе этих 2-ух подходов.
В общем случае при растворении происходит изменение параметров и растворителя, и растворенного вещества, что обосновано взаимодействием частиц меж собой по разным типам взаимодействия: Ван-дер-Ваальсового (во всех случаях), ион-дипольного (в смесях электролитов в полярных растворителях), специфичных взаимодействий (образование водородных либо донорно-акцепторных связей). Учет всех этих взаимодействий представляет собой очень сложную задачку. Разумеется, что чем больше концентрация раствора, тем лучше взаимодействие частиц, тем труднее структура раствора. Потому количественная теория разработана только для безупречных смесей, к которым можно отнести газовые смеси и смеси неполярных жидкостей, в каких энергия взаимодействия разнородных частиц EA-B близка к энергиям взаимодействия схожих частиц EA-A и EB-B.
Безупречными можно считать также нескончаемо разбавленные смеси, в каких можно пренебречь взаимодействием частиц растворителя и растворенного вещества меж собой. Характеристики таких смесей зависят только от концентрации растворенного вещества, но не зависят от его природы.
Растворимость газов в жидкостях находится в зависимости от ряда причин: природы газа и воды, давления, температуры, концентрации растворенных в воды веществ (в особенности очень оказывает влияние на растворимость газов концентрация электролитов). Растворимость водянистых и твёрдых веществ в воде — фактически только от температуры.
В отсутствие хим взаимодействия газы смешиваются вместе в всех пропорциях, и в данном случае гласить о насыщении нет смысла. Но при растворении газа в воды существует некоторая максимальная концентрация, зависящая от давления и температуры. Растворимость газов в неких жидкостях коррелирует с их способностью к сжижению. Более просто сжижаемые газы, к примеру NH3, HCl, SO2, более растворимы, чем тяжело сжижаемые газы, к примеру O2, H2 и He. При наличии хим взаимодействия меж растворителем и газом (к примеру, меж водой и NH3 либо HCl) растворимость возрастает.
Наибольшее воздействие на растворимость газов в жидкостях оказывает природа веществ. Так, в 1 литре воды при t = 18 °С и P = 1 атм. растворяется 0.017 л. азота, 748.8 л. аммиака либо 427.8 л. хлороводорода. Аномально высочайшая растворимость газов в жидкостях обычно обусловливается их специфичным взаимодействием с растворителем – образованием хим соединения (для аммиака) либо диссоциацией в растворе на ионы (для хлороводорода). Газы, молекулы которых неполярны, растворяются, обычно, лучше в неполярных жидкостях – и напротив.
Зависимость растворимости газов от давления выражается законом Генри – Дальтона, который говорит, что растворимость газа в воды прямо пропорциональна его давлению над жидкостью.
С=kP
Тут С – концентрация раствора газа в воды, k – коэффициент пропорциональности, зависящий от природы газа. Закон Генри – Дальтона справедлив только для разбавленных смесей при малых давлениях, когда газы можно считать безупречными. Газы, способные к специфичному взаимодействию с растворителем, данному закону не подчиняются.
Растворимость газов в жидкостях значительно находится в зависимости от температуры; количественно данная зависимость определяется уравнением Клапейрона – Клаузиуса (тут X – мольная толика газа в растворе, ? – термический эффект растворения 1 моля газа в его насыщенном растворе):
Обычно, при растворении газа в воды выделяется теплота (? < 0), потому с увеличением температуры растворимость миниатюризируется. Растворимость газов в воды также очень находится в зависимости от концентрации других растворенных веществ.
Таблица.
Растворимость газов в воде (мольная — молярная долевая концентрация в состоянии термодинамического равновесия ) при парциальном давлении 101325 кПа в 1 л воды.
x (B) — мольная толика газа B, цифра в таблице соответствует мольной доле умноженной на приводной коэффициент из левого столбца. Т.е. x(Ar)=4,284*106 .
Зависимость растворимости газов от концентрации электролитов в воды выражается формулой Сеченова (X и Xo – растворимость газа в чистом растворителе и растворе электролита с концентрацией C):
Таким макаром, растворимость газов в воде находится в зависимости от ее температуры, и от их концентрации в воздухе, так именуемом, парциальном давлении газа.
Ниже в таблице приведены данные по растворимости газов в воде в мл растворенного вещества на 100 г H2O при разных температурах и при их парциальном давлении, равном нормальному атмосферному давлению. Температура (в оС) указана верхним индексом при значении растворимости.
Таблица. Растворимость газов в воде.
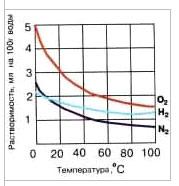
В природной воде могут газов в воде быть растворены газы как воздушного (атмосферного), так и подземного происхождения. В более пресной дождевой воде сначала растворяются кислород и азот. Как понятно, воздушная смесь газов земной атмосферы в главном состоит из 79 частей азота и 21 части кислорода. Хотя растворимость кислорода практически вдвое выше растворимости азота, все таки в воде азота растворяется практически вдвое больше, чем кислорода (рис. 12).
Как я уже произнес, растворимость в воде газов различна и находится в зависимости от ряда причин: температуры, давления, минерализации, присутствия в аква растворе других газов. С увеличением температуры до 90 °С растворимость газов в воде понижается, а потом растет. Так, в 1 л воды при температуре 20 °С растворяется 665 мл углекислого газа, а при 0°С — втрое больше, 1713 мл. При температуре 0°С в 1 л воды может быть растворено, мл: гелия — 10, сероводорода — 4630, аммиака— 1 300000. Как видно из этих примеров, растворимость зависит и от состава самого газа.
 Увеличение давления тянет за собой повышение растворимости газов. К примеру, при давлении 25атм в 1 л воды растворяется углекислого газа 16,3 л, а при 53 атм — 26,9.
Увеличение давления тянет за собой повышение растворимости газов. К примеру, при давлении 25атм в 1 л воды растворяется углекислого газа 16,3 л, а при 53 атм — 26,9.
Рис. 12. Зависимость растворимости газов – кислорода, азота и водорода в воде от температуры (при атмосферном давлении).
А вот при повышении минерализации воды растворимость газа падает. Так, при 0°С растворимость кислорода в 1 л воды с минерализацией наименее 1 г/л составляет 49 мл, а при минерализации 30 г/л — только 15, т. е. втрое меньше.
Из всего произнесенного можно прийти к выводу о том, что растворимость газа в природной воде при неизменных температуре и степени минерализации прямо пропорциональна давлению газа на жидкость, для газовых консистенций она пропорциональна давлению каждого газа в отдельности. Но это справедливо для сравнимо маленьких давлений. При значимых давлениях, к примеру на огромных глубинах в океане, где давление тотчас добивается сотен и даже тыщи атмосфер, на растворимость газов в воде оказывает влияние не парциальное давление отдельных газов, а общее давление всего столба воды.
Таким макаром, суммируя вышеупомянутое можно сделать последующие выводы. Так как растворение газов в воде представляет собой экзотермический процесс, их растворимость с увеличением температуры миниатюризируется. Если бросить в теплом помещении стакан с прохладной водой, то внутренние стены его покрываются пузырьками газа — это воздух, который был растворен в воде, выделяется из нее вследствие нагревания. Означает, обычным кипячением воды можно удалить из воды весь растворенный в ней воздух.
Процесс растворения подчиняется принципу Ле Шателье (1884): если на систему, находящуюся в равновесии, оказывается какое-либо воздействие, то в итоге протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится. Растворение газов в жидкостях обычно сопровождается выделением тепла. При всем этом, в согласовании с принципом Ле Шателье, растворимость газов миниатюризируется. Это уменьшение тем заметнее, чем выше растворимость газов: такие газы имеют и огромную теплоту растворения. «Мягкий» вкус кипяченой либо дистиллированной воды разъясняется отсутствием в ней воздуха, так как его растворимость при высочайшей температуре очень мала. Но при кипячении воды нарушается равновесие из-за улетучивания из неё газов, потому кипяченая вода, чтоб вернуть его, опять поглощает эти газы из воздуха. Потому на практике, растворимость многих газов в воде миниатюризируется до определённой предельной температуры (обычно 90 градусов по Цельсию), потом выше этой температуры растворимость газов в воде опять начинает возрастать.
Аквариумисты нередко сталкиваются с таким явлением: при увеличении температуры воды рыбам становится сложнее дышать, они подымаются к поверхности и заглатывают воздух. Это как раз и связано с уменьшением растворимости кислорода. И растениеводом не рекомендуется поливать цветочки кипячёной водой также по этой причине.
Таблица. Растворимость газов в 100 г воды при обычном атмосферном давлении и температуре 20°C
Таблица 2. Растворимость кислорода в 100 г воды при обычном атмосферном давлений и разных температурах
Но растворение газов в органических жидкостях часто сопровождается поглощением теплоты; в схожих случаях с ростом температуры до определённого момента растворимость газа возрастает.
С ростом давления растворимость газов возрастает. Согласно закону Генри (1803), масса газа, который может раствориться в данном объеме воды при неизменной температуре, пропорциональна его давлению.
Закон Генри может быть выражен уравнением
С = kp
где С — массовая концентрация газа в насыщенном растворе; р— парциальное давление; k—коэффициент пропорциональности, именуемый константой Генри (либо коэффициентом Генри).
Это свойство употребляется для изготовления газированных напитков. Углекислый газ растворяют в воды при давлении 3–4 атм.; в этих критериях в данном объеме может раствориться в 3–4 раза больше газа (по массе), чем при 1 атм. Когда емкость с таковой жидкостью открывают, давление в ней падает, и часть растворенного газа выделяется в виде пузырьков. Аналогичный эффект наблюдается при открывании бутылки шампанского либо выходе на поверхность подземных вод, насыщенных на большой глубине углекислым газом.
Вообщем, при растворении газа в воды устанавливается равновесие:
Газ + Жидкость = Насыщенный раствор газа в воды
При всем этом объем системы значительно миниатюризируется. Как следует, увеличение давления должно приводить к смещению равновесия на право, т. е. к повышению растворимости газа. И напротив, уменьшение давления (создание вакуума) должно приводить к уменьшению растворимости газов в воде. Вот Вам 2-ой метод уменьшить растворимость газов в воде – создание разрежения в ёмкости.
Воздействие увеличения давления на растворимость газа в воде видно из последующего примера. В системе водяного отопления восьмиэтажного строения (высота системы 23 м) большая растворимость воздуха в воде наблюдается при температуре при температуре 95 °С
К этому же выводу можно придти, исходя из динамического нрава равновесия меж газом и его веществом в воды. Молекулы газа, находящиеся над жидкостью в закрытом сосуде, бомбят поверхность воды и растворяются в воды со скоростью, пропорциональной концентрации газа. Перешедшие в раствор молекулы в свою очередь временами ударяются о поверхность воды изнутри и вылетают наружу. По мере того как в итоге растворения концентрация растворенных молекул будет возрастать, скорость их выделения, т. е. число молекул, уходящих из раствора в единицу времени, тоже будет расти, пока, в конце концов, не сравняется со скоростью растворения. В итоге установятся состояние равновесия, т. е. жидкость станет насыщенной газом.
Если сейчас прирастить давление газа, к примеру, в 2 раза, то во столько же раз возрастет и концентрация его молекул над жидкостью, а как следует, и скорость растворения газа. Равновесие нарушится. Чтоб при новеньком давлении опять установилось равновесие, концентрация растворенных молекул, разумеется, тоже должна возрости в два раза.
Не считая вышесказанных способов удаления газов из воды кипячением воды и созданием вакуума имеются хим методы удаления газов из воды.
В большинстве случаев в процессе водоподготовки требуется удаление углекислоты, кислорода и сероводорода. Все три газа относятся к коррозийно-агрессивным газам, обусловливающим либо усиливающим процессы коррозии металлов. Углекислота, не считая того, агрессивна по отношению к бетону. Свойство этих газов обусловливать и усиливать коррозийные процессы, также противный запах, который докладывает воде сероводород, в почти всех случаях вызывают необходимость более полного удаления их из воды.
Комплекс мероприятий, связанных с удалением из воды растворенных в ней газов, именуется дегазацией воды.
Используются хим и физические методы дегазаций воды.
Суть первых заключается в использовании определенных реагентов, которые связывают растворенные в воде газы. К примеру, удаление из воды кислорода может быть достигнуто методом введения в нее сульфита натрия, сернистого газа либо гидразина. Сульфит натрия при внедрении его в воду окисляется растворенным в воде кислородом до сульфата натрия:
2Na2SO3 + О2 -> 2Na2SO4.
В случае внедрения сернистого газа появляется сернистая кислота:
SO2 + Н2О -> H2SO3,
которая кислородом, растворенным в воде, окисляется до серной кислоты:
2H2SO3 + O2 -> H2SO4.
Хим реагентом, при помощи которого удается достигнуть фактически полного удаления из воды кислорода, является гидразин. При внедрении его в воду происходит связывание кислорода и выделение инертного азота:
N2H4 + O2-> 2H2O + N2.
Последний хим метод удаления из воды кислорода является более совершенным, но совместно с тем и более дорогим ввиду высочайшей цены гидразина. Потому этот метод внедрения в главном для окончательного удаления кислорода из воды после физических способов удаления кислорода.
Примером хим способа удаления из воды сероводорода может служить обработка воды хлором:
а) с окислением до серы:
H2S + Н2О -> S + 2HCl;
б) с окислением до сульфатов:
H2S + 4 Н2О -> H2SO4+ 8HCl
Эти реакции (так же как промежные реакции образования тиосульфатов и сульфитов) протекают параллельно в определенных соотношениях, зависящих сначала от концентрации хлора и рН воды.
Хим способам удаления газов из воды характерны последующие недочеты:
а) необходимость внедрения реагентов, усложняющих и удорожающих процесс обработки воды;
б) возможность ухудшения свойства воды при нарушении дозы реагентов.
Вследствие этого хим способы удаления газов из воды используются существенно пореже физических.
Физические способы удаления из воды растворенных газов могут осуществляться 2-мя методами:
1) вода, содержащая удаляемый газ, приводится в соприкосновение с воздухом, если парциальное давление удаляемого газа в воздухе близко к нулю;
2) создаются условия, при которых растворимость газа в воде становится близкой к нулю.
С помощью первого метода, т. е. с помощью аэрации воды, обычно удаляются свободная углекислота и сероводород, так как парциальное давление этих газов в атмосферном воздухе близко к нулю.
Ко второму методу обычно приходится прибегать при удалении кислорода из воды, потому что при значимом парциальном давлении кислорода в атмосферном воздухе аэрацией воды кислород из нее удалить нельзя. Для удаления из воды кислорода ее доводят до кипения, при котором растворимость всех газов в воде падает до нуля. Вода доводится до кипения или ее нагреванием (тепловые деаэраторы), или методом снижения давления до такового значения, при котором вода бурлит при данной ее температуре (вакуумные дегазаторы).
Так что способов дегазации воды существует много. Относительно льда, то в текущее время понятно 14 структурных модификаций льда и может быть, в предстоящем учёные откроют и другие модификации льда. Две последние модификации льда — XIII и XIV — открыли ученые из Оксфорда совершенно не так давно, в 2006 году. Предположение о том, что должны существовать кристаллы льда с моноклинной и ромбической решетками, было тяжело подтвердить: вязкость воды при температуре –160°С очень высока, и собраться совместно молекулам незапятанной переохлажденной воды в таком количестве, чтоб образовался эмбрион кристалла, тяжело. Этого удалось достигнуть при помощи катализатора — соляной кислоты, которая повысила подвижность молекул воды при низких температурах. В земной природе подобные модификации льда создаваться не могут, но они могут встречаться на замерзших спутниках других планет.
Табл. 3. — Некие данные о структурах модификаций льда
Посреди модификаций льда есть и кристаллические (их большая часть) и бесформенные модификации, но они все отличаются друг от друга обоюдным расположением молекул воды и качествами. Известен лёт и гексагональной, и кубической, и тригональной, и тетрагональной, моноклинной конфигурации. Правда, все, не считая обычного нам льда, кристаллизующего в гексагональной решётке, образуются в критериях экзотичных — при очень низких температурах и больших давлениях, когда углы водородных связей в молекуле воды меняются и образуются системы, хорошие от гексагональной. Такие условия напоминают галлактические и не встречаются на Земле. К примеру, при температуре ниже –110 °С водяные пары выпадают на железной пластинке в виде октаэдров и кубиков размером в несколько нанометров — это так именуемый кубический лед. Если температура чуток выше –110 °С, а концентрация пара очень мала, на пластинке формируется слой только плотного бесформенного льда. Но самое необыкновенное свойство льда — это необычное обилие наружных проявлений. При одной и той же кристаллической структуре он может смотреться совсем по-разному, принимая форму прозрачных градин и сосулек, хлопьев лохматого снега, плотной блестящей корки льда либо циклопических ледниковых масс.
Разгадка структуры льда заключается в строении его молекулы. Кристаллы всех модификаций льда построены из молекул воды H2O, соединённых водородными связями в трёхмерный каркас. Молекулу воды можно упрощенно представить для себя в виде тетраэдра (пирамиды с треугольным основанием). В её центре находится атом кислорода, в 2-ух верхушках — по атому водорода, электроны которых задействованы в образовании ковалентной связи с кислородом. Две оставшиеся верхушки занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей, потому их именуют неподеленными.
Рис. Структура льда.
Любая молекула участвует в 4 таких связях, направленных к верхушкам тетраэдра. При содействии протона одной молекулы с парой неподеленных электронов кислорода другой молекулы появляется водородная связь, наименее мощная, чем связь внутримолекулярная, но довольно могущественная, чтоб задерживать рядом примыкающие молекулы воды. Любая молекула может сразу создавать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28′, направленных к верхушкам тетраэдра, которые не позволяют при замерзании создавать плотную структуру. При всем этом в структурах льда I, Ic, VII и VIII этот тетраэдр верный. В структурах льда II, III, V и VI тетраэдры приметно искажены. В структурах льда VI, VII и VIII можно выделить 2 взаимоперекрещивающиеся системы водородных связей. Этот невидимый каркас из водородных связей располагает молекулы в виде сетчатой сетки, по структуре напоминающей соты с полыми каналами. Если лед подогреть, сетчатая структура разрушится: молекулы воды начинают проваливаться в пустоты сетки, приводя к более плотной структуре воды, — потому вода тяжелее льда.
Следует признать, что самый обыденный лед, который появляется при атмосферном давлении и плавится при 0 °С, — самое обычное, но всё же до конца не изученное вещество.
С почтением,
К.х.н. О.В. Мосин