 Вода и лед – знаем ли мы о их довольно?
Вода и лед – знаем ли мы о их довольно?
Вода и лед – знаем ли мы о их довольно? Ю. И. ГОЛОВИН
Тамбовский муниципальный институт им. Г.Р. Державина
Соросовский образовательный журнальчик, том 6, №9, 2000
Water and ice: do we know enough about them?
Yu. I. GOLOVIN
The physical properties of water and ice are described. Mechanisms of various phenomena in these substances are discussed. In spite of the long period of study and simple chemical composition, water and ice – the substances highly valuable for life on earth – harbour many mysteries because of their complicated dynamic proton and molecular structure.
Дан лаконичный обзор физических параметров воды и льда. Рассмотрены механизмы различных явлений в их. Показано, что, невзирая на многолетнюю историю исследования, простой хим состав и исключительную значимость для жизни на Земле, природа воды и льда таит внутри себя много загадок из-за сложной динамической протонной и молекулярной структуры.
Хоть простота нужнее людям,
Все ж сложное понятней им.
Б.Л. Пастернак
Пожалуй, на Земле нет более всераспространенного и в то же время более таинственного вещества, чем вода в водянистой и жесткой фазах. Вправду, довольно вспомнить, что все живое вышло из воды и состоит из нее более чем на 50%, что 71% поверхности Земли покрыт водой и льдом, а значимая часть северных территорий суши представляет собой нескончаемую мерзлоту. Чтоб наглядно представить для себя суммарное количество льда на нашей планетке, заметим, что в случае их таяния вода в Мировом океане подымется более чем на 50 м, что приведет к затоплению циклопических территорий суши на всем земном шаре. Во Вселенной, в том числе и в Солнечной системе, обнаружены большие массы льда. Нет ни 1-го мало-мальски существенного производства, бытовой деятельности человека, в какой не использовалась бы вода. В последние десятилетия обнаружены огромные припасы горючего в виде жестких льдообразных гидратов природных углеводородов.
Совместно с тем после бессчетных фурроров физики и физикохимии воды последних лет [1–5] навряд ли можно утверждать, что характеристики этого обычного вещества понятны и предсказуемы до конца. В истинной статье дан лаконичный обзор важных физических параметров воды и льда и нерешенных заморочек, относящихся приемущественно к физике их низкотемпературных состояний.
Эта сложная молекула
Базы современного осознания физикохимии воды заложили около 200 годов назад Генри Кавендиш и Антуан Лавуазье, обнаружившие, что вода – это не обычный хим элемент, как считали средневековые алхимики, а соединение кислорода и водорода в определенном отношении. Фактически и заглавие свое водород (hydrogene) – рождающий воду – получил только после чего открытия, и вода заполучила современное хим обозначение, известное сейчас каждому школьнику, – H2O.
Итак, молекула H2O построена из 2-ух атомов водорода и 1-го атома кислорода. Как установлено исследовательскими работами оптических спектров воды, в гипотетичном состоянии полного отсутствия движения (без колебаний и вращений) ионы водорода и кислорода должны занимать положения в верхушках равнобедренного треугольника с углом в верхушке, занятой кислородом, 104,5° (рис. 1, а). В невозбужденном состоянии расстояния меж ионами H+ и O2? равны 0,96 A. Благодаря такому строению молекула воды является диполем, так как электрическая плотность в области расположения иона O2? существенно выше, чем в области ионов H+, и простая модель – модель шаров – плохо подходит для описания параметров воды. Можно представить для себя молекулу воды в виде шара с 2-мя маленькими вздутиями в области расположения протонов (рис. 1, б). Но и это не помогает осознать другую особенность воды – способность создавать меж молекулами направленные водородные связи, играющие большенную роль в формировании ее разрыхленной, но совместно с тем очень устойчивой пространственной структуры, определяющей большая часть физических параметров как в водянистом, так и жестком состоянии.
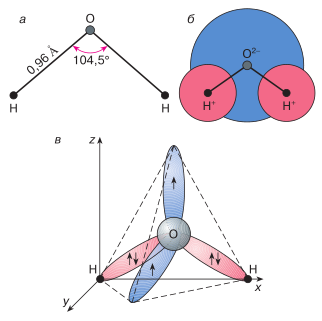
Рис. 1. Геометрическая схема (а), плоская модель (б) и пространственная электрическая структура (в) мономера H2O. Два из 4 электронов наружной оболочки атома кислорода участвуют в разработке ковалентных связей с атомами водорода, а два других образуют очень вытянутые электрические орбиты, плоскость которых перпендикулярна плоскости H–O–H
Напомним, что водородной именуется такая связь меж атомами в одной молекуле либо примыкающими молекулами, которая осуществляется через атом водорода. Она занимает среднее положение меж ковалентной и невалентной связью и появляется в этом случае, когда атом водорода размещается меж 2-мя электроотрицательными атомами (O, N, F и т.д.). Электрон в атоме Н относительно слабо связан с протоном, потому максимум электрической плотности сдвигается к более электроотрицательному атому, а протон оголяется и начинает вести взаимодействие с другим электроотрицательным атомом. При всем этом происходит сближение атомов О???О, N???О и т.д. на расстояние, близкое к тому, что установилось бы меж ними при отсутствии атома Н. Водородная связь определяет не только лишь структуру воды, да и играет очень важную роль в жизни биомолекул: белков, углеводов, нуклеиновых кислот и т.п.
Разумеется, для разъяснения природы воды нужно принять во внимание электрическую структуру ее молекул. Как понятно, на верхней оболочке у атома кислорода находятся четыре электрона, а у водорода имеется всего только один электрон. В образовании каждой ковалентной связи O–H участвуют по одному электрону от атомов кислорода и водорода. Два оставшихся у кислорода электрона получили заглавие неподеленной пары, потому что в изолированной молекуле воды они остаются свободными, не участвуя в образовании связей снутри молекулы H2O. Но при сближении с другими молекулами конкретно эти неподеленные электроны и играют решающую роль в образовании молекулярной структуры воды.
Неподеленные электроны отталкиваются от связей O–H, потому их орбиты очень вытянуты в сторону, обратную атомам водорода, а плоскости орбит направлены относительно плоскости, образованной связями O–H–O. Таким макаром, вернее молекулу воды было бы изображать в трехмерном пространстве координат xyz в виде тетраэдра, в центре которого находится атом кислорода, а в 2-ух верхушках – по атому водорода (рис. 1, в). Электрическая структура молекул H2O определяет условия их объединения в сложную трехмерную сеть водородных связей как в воде, так и во льду. Любой из протонов может создавать связь с неподеленным электроном другой молекулы. 1-ая молекула при всем этом выступает в качестве акцептора, а 2-ая – донора, образовывая водородную связь. Так как любая молекула H2O имеет два протона и два неподеленных электрона, она может сразу создавать четыре водородные связи с другими молекулами. Таким макаром, вода является сложной ассоциированной жидкостью с динамическим нравом связей, и описание ее параметров на молекулярном уровне может быть только при помощи квантово-механических моделей различной степени трудности и строгости.
Лед и его характеристики
Исходя из убеждений обыденного человека, лед более либо наименее схож независимо от того, где он создается: в атмосфере в виде градинок, на краях крыш в виде сосулек либо в водоемах в виде пластинок. Исходя из убеждений физики имеется огромное количество разновидностей льда, отличающихся собственной молекулярной и мезоскопической структурой. Во льду, существующем при обычном давлении, любая молекула H2O окружена 4-мя другими, другими словами координационное число структуры равно четырем (так именуемый лед Ih). Соответственная кристаллическая решетка – гексагональная – не является плотноупакованной, потому плотность обыденного льда (?0,9 г/см3) ниже плотности воды (?1 г/см3), для структуры которой, как демонстрируют рентгеноструктурные исследования, среднее координационное число составляет ?4,4 (против 4 у льда Ih). Фиксированные положения в структуре льда занимают только атомы кислорода. Два атома водорода могут занимать разные положения на 4 связях молекулы H2O с другими соседями. Ввиду гексагональности решетки кристаллики, растущие в свободном состоянии (к примеру, снежинки), имеют шестигранную форму.
Но гексагональная фаза далековато не единственная форма существования льда. Четкое число других кристаллических фаз – полиморфных форм льда – до сего времени непонятно. Они образуются при больших давлениях и низких температурах (рис. 2). Одни исследователи считают точно установленным наличие 12 таких фаз, в то время как другие насчитывают их до 14. Естественно, это не единственное вещество, владеющее полиморфизмом (вспомните, к примеру, графит и алмаз, состоящие из химически схожих атомов углерода), но количество разных фаз льда, которые продолжают открывать и по нынешний денек, поражает. Все произнесенное выше относилось к упорядоченному расположению ионов кислорода в кристаллической решетке льда. Что касается протонов – ионов водорода, – то, как показано способом дифракции нейтронов, в их расположении существует сильный кавардак. Таким макаром, кристаллический лед является и отлично упорядоченной средой (по кислороду) и сразу разупорядоченной (по водороду).
Часто кажется, что лед податлив и текуч. Так оно и есть, если температура близка к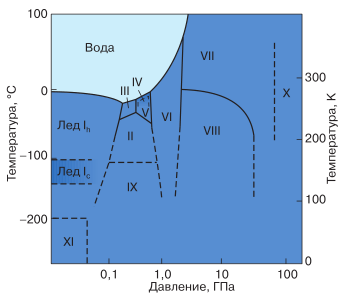
Рис. 2. Фазовая диаграмма кристаллического льда.
Римскими цифрами обозначены области существо-
вания размеренных фаз. Лед IV – метастабильная фа-
за, размещающаяся на диаграмме снутри области V
точке плавления (другими словами t = 0°С при атмосферном давлении), а нагрузка действует долгое время. Ну и самый жесткий материал (к примеру, металл) при температурах, близких к точке плавления, ведет себя аналогичным образом. Пластическая деформация льда, как, вобщем, и многих других кристаллических тел, происходит в итоге зарождения и движения по кристаллу различных несовершенств структуры: вакансий, межузельных атомов, межзеренных границ и, что существеннее всего, дислокаций. Как было установлено еще в 30-е годы нашего столетия, конкретно наличие последних предназначает резкое понижение сопротивления кристаллических жестких тел пластической деформации (в 102–104 раз по отношению к сопротивлению безупречной решетки). К истинному времени во льду Ih обнаружены все виды дислокаций, характерных гексагональной структуре, изучены их микромеханические и электронные свойства.
Воздействие скорости деформации на механические характеристики монокристаллического льда отлично иллюстрирует рис. 3, взятый из книжки Н. Маэно [2]. Видно, что при увеличении скорости деформирования механические напряжения ?, нужные для пластического течения, стремительно нарастают и на зависимости относительной деформации Е от ? возникает огромный зуб текучести.
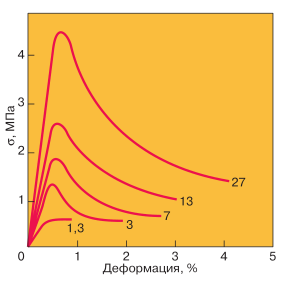
Рис. 3. (по [2]). Кривые напряжения – относительная деформация для монокристалла льда Ih при t = ?15°С (скольжение повдоль базовой плоскости, направленной под углом 45° к оси сжатия). Числа на кривых означают величину скорости относительной деформации (?l – изменение длины эталона l за время ??) в единицах 10?7 с?1
Более замечательны и электронные характеристики льда. Величина проводимости и ее экспоненциально резвое возрастание с увеличением температуры резко отличают лед от железных проводников и ставят его в один ряд с полупроводниками. Обычно лед бывает очень чист химически, даже если вырастает из грязной воды либо раствора (вспомните незапятнанные прозрачные льдинки в грязной луже). Это обосновано низкой растворимостью примесей в структуре льда. В итоге при замерзании примеси оттесняются на фронте кристаллизации в жидкость и не входят в структуру льда. Вот поэтому свежевыпавший снег всегда белоснежный, а вода из него отличается исключительной чистотой.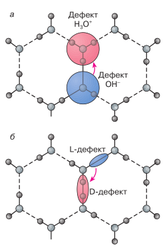
Рис. 4. Схема образования изъянов в протонной подсистеме льда: а – пара ионных изъянов H3O+ и OH?; б – пара ориентационных изъянов Бьеррума D и L
Природа мудро предугадала огромную очищающую станцию для воды в масштабе всей атмосферы Земли. Потому рассчитывать на огромную примесную проводимость (как, к примеру, в легированном кремнии) во льду не приходится. Но в нем нет и свободных электронов, как в металлах. Только в 50-е годы XX века было установлено, что носителями заряда во льду являются неупорядоченные протоны, другими словами лед является протонным полупроводником.
Упоминавшиеся выше перескоки протонов делают в структуре льда недостатки 2-ух типов: ионные и ориентационные (рис. 4). В первом случае перескок протона происходит повдоль водородной связи от одной молекулы H2O к другой (рис. 4, а), в итоге чего появляется пара ионных изъянов H3O+ и ОН?, а во 2-м – на соседнюю водородную связь в одной молекуле Н2О (рис. 4, б), в итоге чего появляется пара ориентационных изъянов Бьеррума, получивших заглавие Lи D-дефектов (от нем. leer – пустой и doppelt – двойной). Формально таковой перескок можно рассматривать как поворот молекулы Н2О на 120°.
Протекание неизменного тока за счет перемещения только ионных либо только ориентационных изъянов нереально. Если, к примеру, по какому-либо участку сетки прошел ион Н3О+, то последующий таковой же ион по этому же пути пройти не сумеет. Но если пропустить по этому пути D-дефект, то размещение протонов возвратится к начальному и, как следует, сумеет пройти и последующий ион Н3О+. Аналогично ведут себя недостатки ОН? и L. Потому электропроводность химически незапятнанного льда ограничивается теми недостатками, которых меньше, а конкретно ионными. Диэлектрическая поляризация, напротив, обоснована более бессчетными ориентационными недостатками Бьеррума. В реальности при приложении наружного электронного поля оба процесса идут параллельно, что позволяет льду проводить неизменный ток и в то же время испытывать сильную диэлектрическую поляризацию, другими словами проявлять сразу и характеристики полупроводника и характеристики изолятора. В последние годы не прекращаются пробы найти при низких температурах у незапятнанного льда сегнетоэлектрические и пьезоэлектрические характеристики как в объеме, так и на межфазных границах. Полной убежденности в их существовании пока нет, хотя найдено несколько псевдопьезоэффектов, связанных с наличием дислокаций и других структурных изъянов.
Физика поверхности и кристаллизации льда
В связи с развитием полупроводниковой техники, микроминиатюризацией элементной базы и переходом к планарным технологиям энтузиазм к физике поверхности в последнее десятилетие очень возрос. Было создано огромное количество тонких методик исследования приповерхностных состояний в жестких телах, оказавшихся полезными в исследовании и металлов, и полупроводников, и диэлектриков. Но структура и характеристики поверхности льда, граничащей с паром либо жидкостью, остается почти во всем неясной. Одна из более интригующих гипотез, выдвинутая еще М. Фарадеем, заключается в существовании на поверхности льда квазижидкого слоя шириной в десятки-сотни ангстрем даже при температуре существенно ниже точки плавления. Основанием для этого являются не только лишь умозрительные построения и теории структуры приповерхностных слоев из очень поляризованных молекул H2O, да и тонкие определения (способом ядерного магнитного резонанса) фазового состояния поверхности льда, также его поверхностной проводимости и ее зависимости от температуры. Но в большинстве фактически принципиальных случаев характеристики поверхности снега и льда, вероятнее всего, определяются наличием макроскопической водяной пленки, а не квазижидкого слоя.
Плавление приповерхностных слоев льда под действием солнечного света, более теплой атмосферы либо скользящего по нему твердого тела (коньки, лыжи, полозья санок) имеет решающее значение для реализации низкого коэффициента трения. Низкое трение скольжения не итог снижения температуры плавления под действием завышенного давления, как нередко задумываются, а следствие выделения теплоты трения. Расчет указывает, что эффект давления даже в случае скольжения остро наточенного конька по льду, под которым развивается давление около 1 МПа, приводит к снижению температуры плавления всего только на ?0,1°С, что не может оказать существенного воздействия на величину трения.
Установившейся традицией в описании параметров воды и льда являются констатация и обсуждение огромного количества не нормальных параметров, выделяющих это вещество посреди гомологов (Н2S, H2Se, H2Te). Чуть ли не важнейшим является очень высочайшая (посреди обычных веществ) удельная теплота плавления (кристаллизации) и теплоемкость, другими словами лед тяжело растопить, а воду – заморозить. В итоге климат на нашей планетке в целом довольно мягок, но при отсутствии воды (к примеру, в пустынях горячей Африки) контраст меж дневной и ночной температурами существенно выше, чем на побережье океана на той же широте. Актуально принципиальным для биосферы является свойство возрастать в объеме при кристаллизации, а не уменьшаться, как это делает абсолютное большая часть узнаваемых веществ. В итоге лед плавает в воде, а не утопает и очень замедляет вымерзание водоемов в прохладное время, защищая все живое, укрывающееся в нем на зиму. Этому также содействует и немонотонное изменение плотности воды при снижении температуры до 0°С – одно из более узнаваемых не нормальных параметров воды, обнаруженное более 300 лет тому вспять. Максимум плотности достигается при t = 4°С, и это предутверждает опускание на дно приповерхностных слоев воды, остывших до температуры ниже 4°С. Конвективное смешивание воды блокируется, что очень замедляет предстоящее остывание. Довольно издавна известны и другие аномалии воды: сдвиговой вязкости при 20°С, удельной теплоемкости при 40°С, изотермической сжимаемости при 46°С, скорости распространения звука при 60°С. Вязкость воды с ростом давления миниатюризируется, а не возрастает, как у других жидкостей. Ясно, что аномальные характеристики воды обоснованы структурными особенностями ее молекулы и специфичностью межмолекулярных взаимодействий. Полной ясности в отношении последних до сего времени не достигнуто. Описанные выше характеристики относятся к воде, льду и границе раздела меж ними, имеющимся в критериях термодинамического равновесия. Задачки совершенно другого уровня трудности появляются при попытке описания динамики фазового перехода вода–лед, в особенности в критериях, дальних от термодинамического равновесия.
Термодинамической предпосылкой хоть какого фазового перехода является разность хим потенциалов частиц по одну и другую сторону от межфазной границы ?µ = µ1?µ2. Хим потенциалом µ именуют функцию состояния, которая определяет конфигурации термодинамических потенциалов при изменении числа N частиц в системе, другими словами µ = G/N, где G = H ? TS – термодинамический потенциал Гиббса, Н – энтальпия, S – энтропия, Т – температура. Разность термодинамических потенциалов является движущей силой макроскопического процесса (как разность электронных потенциалов на концах проводника является предпосылкой электронного тока). При µ1 = µ2 обе фазы могут сосуществовать в равновесии как угодно длительно. При обычном давлении хим потенциал воды уравнивается с хим потенциалом льда при t = 0°С. При t < 0°С более низким хим потенциалом обладает лед, но это еще не значит, что при любом, самом небольшом переохлаждении начнется кристаллизация. Опыт указывает, что кропотливо очищенный от примесей, обезгаженный, деионизированный расплав может быть переохлажден относительно точки равновесия фаз на 10-ки кельвин (а для неких веществ и на сотки). Анализ указывает, что причина заключается в отсутствии эмбрионов новейшей фазы (центров кристаллизации, конденсации, парообразования и т.д.).
Эмбрионы могут образоваться и гомогенно, другими словами из самой среды, находящейся в метастабильном состоянии, но для этого должны быть выполнены определенные условия. Начнем рассмотрение ситуации с учета того, что неважно какая граница раздела меж кристаллом и расплавом (либо паром, веществом) заносит дополнительную энергию S?, где S – площадь границы, ? – поверхностная энергия. Не считая того, N молекул, образовавших зародышевый кристаллик, владеют энергией, наименьшей, чем в воды, на N?µ. В итоге полное изменение энергии в системе при возникновении эмбриона ?U = ?N?µ + S? окажется немонотонно зависящим от N. Вправду, при сферической форме эмбриона
где A = (36?V2)1/3 V – объем, приходящийся на одну молекулу в кристалле. Из предшествующего следует, что ?U добивается максимума ?Uc = — Nc?µ + ANc2/3?, когда в эмбрионе находится Nс = (2A?/3?µ)3 молекул.
Таким макаром, при поочередном присоединении молекул к эмбриону система поначалу должна взбираться на верхушку потенциального холмика высотой ?Uс, зависящей от переохлаждения, после этого предстоящий рост N в кристаллике будет идти с снижением энергии, другими словами облегченно. Казалось бы, чем ниже температура воды, другими словами чем посильнее переохлаждение, тем резвее должна идти кристаллизация. Так оно и есть по сути при не очень огромных переохлаждениях. Но с падением t экспоненциально стремительно наращивается и вязкость воды, затрудняющая движение молекул. Вследствие этого при огромных степенях переохлаждения процесс кристаллизации может затянуться на много лет (как в случае со стеклами различного происхождения).
Численные оценки демонстрируют, что для воды при обыденных в природных критериях степенях переохлаждения (?t = 1–10°С) эмбрион должен состоять из нескольких 10-ов молекул, что существенно больше координационного числа в водянистой фазе (?4,4). Таким макаром, системе требуется огромное количество флуктуационных попыток, чтоб взобраться на верхушку энергетического холмика. В не очень кропотливо чистой воде сильному переохлаждению препятствует наличие уже имеющихся центров кристаллизации, которыми могут стать частички примесей, пылинки, выпуклости стен сосуда и др. В следующем кинетика роста кристалла находится в зависимости от критерий теплопередачи поблизости межфазной границы, также от морфологии последней на атомарно-молекулярном уровне.
У очень переохлажденной воды имеются две соответствующие температуры th = ?36°C и tg = ?140°C. Отлично очищенная и обезгаженная вода в интервале температур 0°С > t > th долгое время может оставаться в состоянии переохлажденной воды. При tg < t < th происходит гомогенное зарождение кристалликов льда, и вода не может находиться в переохлажденном состоянии при хоть какой степени чистки. В критериях довольно резвого остывания при t 20%).
Существует несколько точек зрения на природу полиаморфизма воды. Так, согласно [5], такое поведение очень переохлажденной воды может быть объяснено, если принять, что в возможном профиле взаимодействия 2-ух молекул Н2О имеется не один минимум,
Рис. 5 (по [5]). Гипотетичные потенциальные профили: а – с одним минимумом энергии (к примеру, потенциал Леннарда-Джонса U(r) = A/r6 ? B/r12) и б –с 2-мя минимумами энергии, которым соответствуют две устойчивые конфигурации кластера из 2-ух взаимодействующих молекул воды (1 и 2) с различными расстояниями меж условными центрами молекул rH и rL; 1-ая из их соответствует фазе с большей плотностью, 2-ая – с наименьшей
а два (рис. 5). Тогда бесформенной фазе с высочайшей плотностью будет соответствовать среднее расстояние rH, а фазе с низкой плотностью – rL. Компьютерное моделирование подтверждает такую точку зрения, но надежных экспериментальных доказательств этой догадки пока нет, как нет и серьезной теории, подтверждающей обоснованность использования двухъямного потенциала для описания настолько необыкновенных параметров переохлажденной воды.
Поведение переохлажденной воды представляет большой энтузиазм в силу разных обстоятельств. А именно, оно определяет климатические условия, возможность и режим судоходства в больших широтах, что животрепещуще для нашей страны. В процессе динамической кристаллизации на межфазной границе происходит огромное количество увлекательных и пока практически неизученных явлений, к примеру перераспределение примесей, сепарация и следующая релаксация электронных зарядов, сопровождающаяся электрическим излучением в широкой полосе частот, и др. В конце концов, кристаллизация в очень переохлажденной воды – красивая, просто воспроизводимая неоднократно модельная ситуация поведения системы, дальной от термодинамического равновесия и способной в итоге развития неустойчивостей к образованию дендритов различного порядка и размерности (обычные представители – снежинки и ледяные узоры на окнах), комфортной для сотворения и моделирования поведения фракталов [6].
Процессы таяния льда на 1-ый взор кажутся легче для анализа, чем процессы кристаллизации. Но и они оставляют огромное количество вопросов. Так, к примеру, обширно всераспространено мировоззрение, что талая вода некое время обладает качествами, хорошими от параметров воды обыкновенной, по последней мере по отношению к биологическим объектам: растениям, животным, человеку. Возможно, эти особенности могут быть обоснованы высочайшей хим чистотой (из-за отмеченного малого коэффициента захвата примесей в процессе кристаллизации льда), различиями в содержании растворенных газов и ионов, также запоминанием структуры льда в многомолекулярных кластерах водянистой фазы. Но достоверной инфы об этом, приобретенной современными физическими способами, у создателя нет.
Более сложным представляется анализ устройств воздействия наружных физических полей, а именно магнитного, на процессы и характеристики воды, льда и фазовых переходов. Вся наша жизнь протекает в критериях неизменного деяния магнитного поля Земли и его слабеньких флуктуаций. В течение многих веков развиваются магнитобиология и магнитные способы исцеления в медицине. В конце концов, серийно выполняются и обширно используются установки для омагничивания воды, применяемой для полива в сельском хозяйстве (в целях увеличения урожайности), питания паровых котлов (для уменьшения скорости образования накипи в их) и т.д. Но сколько-либо удовлетворительного физического описания устройств деяния магнитного поля в этих и других схожих случаях до сего времени нет.
Заключение
Вода, лед и их обоюдные фазовые перевоплощения еще таят внутри себя огромное количество загадок. Их разгадывание представляет собой не только лишь очень увлекательную физическую делему, да и очень принципиально для жизни на Земле, потому что имеет непосредственное отношение к здоровью и благополучию человека. Может быть, они дают один из самых ярчайших примеров роли электрической и молекулярной структуры в формировании физических параметров при простом и отлично известном хим составе вещества.
Литература:
1. Богородский В.В., Гаврило В.П. Лед. Л.: Гидрометеоиздат, 1980. 384 с.
2. Маэно Н. Наука о льде. М.: Мир, 1988. 231 с.
3. Hobbs P.V. Ice Physics. Oxford: Univ. Press, 1974. 864 p.
4. Зацепина Г.Н. Физические характеристики и структура воды. М.:Изд-во МГУ, 1998. 184 с.
5. Mishima O., Stanley E. The Relationship between Liquid, Supercooled and Glassy Water // Nature. 1998. Vol. 396. P. 329–335.
6. Золотухин И.В. Фракталы в физике твердого тела // Соросовский Образовательный Журнальчик. 1998. № 7. С. 108–113. Рецензент статьи Б.А. Струков
* * *
Юрий Иванович Головин, доктор физико-математических наук, доктор, зав. кафедрой теоретической и экспериментальной физики Тамбовского муниципального института им. Г.Р. Державина, заслуженный деятель науки РФ. Область научных интересов — электрическая структура изъянов жестких тел и обусловленные ими макроскопические характеристики. Создатель и соавтор более 200 научных работ, в том числе монографии и 40 изобретений.