 Вода как горючее
Вода как горючее
Вода как горючее
К.х.н. О.В. Мосин
ВОДА КАК Горючее
Вода – самое таинственное вещество в природе, владеющее уникальными качествами, которые не только лишь ещё стопроцентно не объяснены, но далековато не все известны. Чем подольше ее изучают, тем больше находят новых аномалий и загадок в ней. Большая часть из этих аномалий, обеспечивающих возможность жизни на Земле, объясняются наличием меж молекулами воды водородных связей, которые много посильнее вандерваальсовских сил притяжения меж молекулами других веществ, но на порядок величины слабее ионных и ковалентных связей меж атомами в молекулах. К истинному времени больше исследованы лед и водяной пар, чем вода, в отношении которой у исследователей до сего времени нет даже одного представления о ее структуре, хотя кристаллическая структура льда издавна отлично исследована.
Рис. Строение молекулы воды. Геометрическая схема (а), плоская модель (б) и пространственная электрическая структура (в) мономера H2O. Два из 4 электронов наружной оболочки атома кислорода участвуют в разработке ковалентных связей с атомами водорода, а два других образуют очень вытянутые электрические орбиты, плоскость которых перпендикулярна плоскости Н-О-Н.
Удельная теплоемкость воды большая посреди всех веществ. Не считая того, она в 2 раза выше, чем у льда, в то время как практически у всех обычных веществ (к примеру, металлов) в процессе плавления теплоемкость фактически не меняется, а у веществ из многоатомных молекул она, обычно, миниатюризируется при плавлении.
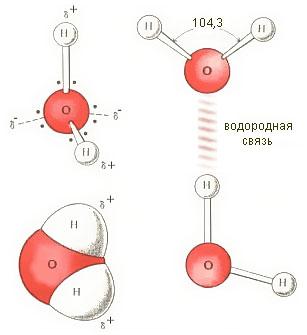 Рис. Водородные связи меж молекулами воды
Рис. Водородные связи меж молекулами воды
Большая часть исследователей разъясняют аномально высшую теплоемкость водянистой воды тем, что при плавлении льда его кристаллическая структура разрушается не сходу. В водянистой воде сохраняются водородные связи меж молекулами. В ней остаются вроде бы осколки льда — ассоциаты из огромного либо наименьшего числа молекул воды. Но в отличие от льда каждый ассоциат существует недолго. Повсевременно происходит разрушение одних и образование других ассоциатов. При каждом значении температуры в воде устанавливается свое динамическое равновесие в этом процессе. А при нагревании воды часть теплоты затрачивается на разрыв водородных связей в ассоциатах. При всем этом на разрыв каждой связи расходуется 0,26-0,5 эВ. Этим и разъясняется аномально высочайшая теплоемкость воды по сопоставлению с расплавами других веществ, не образующих водородных связей. При нагревании таких расплавов энергия расходуется лишь на сообщение термических движений их атомам либо молекулам. Водородные связи меж молекулами воды стопроцентно разрываются только при переходе воды в пар. На корректность таковой точки зрения показывает и то событие, что удельная теплоемкость водяного пара при 100°С фактически совпадает с удельной теплоемкостью льда при 0°С.
 Рис. Кристаллическая структура льда: молекулы воды соединены в правильные шестиугольники
Рис. Кристаллическая структура льда: молекулы воды соединены в правильные шестиугольники
Но существует и другая точка зрения на природу аномально высочайшей теплоемкости воды. Доктор Г. Н. Зацепина в собственной увидела, что молярная теплоемкость воды, составляющая 18 кап/(моль o град), точно равна теоретической молярной теплоемкости твердого тела с трехатомными кристаллами. А в согласовании с законом Дюлонга и Пти атомные теплоемкости всех химически обычных (одноатомных) кристаллических тел при довольно высочайшей температуре схожи и равны 6 калДмоль o град). А для трехатомных, в граммоле которых содержится 3 NA узлов кристаллической решетки, — в 3 раза больше. (Тут NA — число Авогадро).
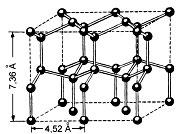
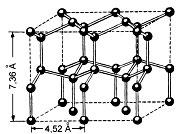 Рис. Кристаллическая решётка льда. Молекулы воды H2O (чёрные шарики) в её узлах размещены так, что любая имеет четырёх „соседок“.
Рис. Кристаллическая решётка льда. Молекулы воды H2O (чёрные шарики) в её узлах размещены так, что любая имеет четырёх „соседок“.
Отсюда следует, что вода является вроде бы кристаллическим телом, состоящим из трехатомных молекул Н20. Это соответствует всераспространенному представлению о воде как консистенции кристаллоподобных ассоциатов с маленький примесью свободных молекул H2O воды меж ними, число которых вырастает с увеличением температуры. С этой точки зрения вызывает удивление не высочайшая теплоемкость водянистой воды, а низкая твердого льда. Уменьшение удельной теплоемкости воды при замерзании разъясняется отсутствием поперечных термических колебаний атомов в жесткой кристаллической решетке льда, где у каждого протона, обуславливающего водородную связь, остается только одна степень свободы для термических колебаний заместо 3-х.
Рис. Отдельный кластер воды
Теплоемкость расплавов металлов, как и большинства других жидкостей, обычно растет (хоть и очень медлительно) с ростом давления. И только у воды удельная теплоемкость миниатюризируется с увеличением давления. На этом свойстве воды желали сыграть разработчики термического насоса. Чтоб попробовать разъяснить эту аномалию воды, вспомним, что с ростом давления температура кипения воды, как и других веществ, увеличивается. В итоге температурный интервал существования воды в водянистом состоянии расширяется с ростом давления. А при увеличении этого интервала содержание в воде ассоциатов — «льдинок» при одной и той же температуре должно становиться тем больше, чем обширнее интервал, т.к. это содержание определяется динамическим равновесием. И хотя ассоциаты — не совершенно льдинки, но их удельная теплоемкость все таки ниже, чем теплоемкость воды. Потому суммарная удельная теплоемкость «консистенции» при высочайшем давлении меньше, чем при низком.
Рис. Кластеры из молекул воды образуют ассоциаты
Можно представить, что при ускорении вращения воды в вихревом теплогенераторе в ней растет содержание ассоциатов, и в итоге этого удельная теплоемкость воды значительно миниатюризируется. Она миниатюризируется, конечно, не за счет увеличения давления при действии центробежных сил, которое некординально, а по каким-то другим причинам. Если это происходит, то вода без конфигурации ее теплосодержания оказывается на выходе теплогенератора горячее, чем была на входе в него. Это, естественно, не добавляет ей энергии, но позволяет при большем перепаде температур в теплообменнике снять с него больше тепла. А остывать после чего такая вода должна резвее и до более низких температур, чем рядовая. Точнее, не остывать, а релаксировать до обыденного состояния термического равновесия в ней льдоподобных ассоциатов и молекул воды, что должно приводить к восстановлению теплоемкости воды до обыкновенной, а вследствие этого к падению ее температуры без термообмена с окружающей средой.
Но за счет чего и как могут происходить настолько огромные конфигурации теплоемкости воды без соответственных конфигураций давления? Чтоб ответить на этот вопрос, познакомимся с догадкой кандидата геолого-минералогических наук Ю. А. Колясникова о структуре воды.
Он показывает, что еще первооткрыватели водородных связей Дж. Бернал и Р. Фаулер в 1932 г. ассоциировали структуру водянистой воды с кристаллической структурой кварца, и утверждает, что те ассоциаты, о которых говорилось выше, — это в главном тетрамеры 4Н20, в каких четыре молекулы воды соединены в малогабаритный тетраэдр с двенадцатью внутренними водородными связями. В итоге появляется четырёхгранная пирамида — тетраэдр.
Водородные связи в этих тетрамерах, утверждает Колясников, могут создавать как правотак и левовинтовую последовательности, подобно тому, как кристаллы обширно распространённого кварца (Si02), тоже имеющие тетраэдрическую структуру, бывают правои лево-вращательной кристаллической форм. Так как каждый таковой тетрамер воды имеет к тому же четыре незадействованные наружные водородные связи (как у одной молекулы воды), то тетрамеры могут соединяться этими наружными связями в собственного рода полимерные цепочки. А так как наружных связей всего четыре, а внутренних — в 3 раза больше, то это позволяет томным и крепким тетрамерам в водянистой воде изгибать, поворачивать и даже надламывать эти ослабленные термическими колебаниями наружные водородные связи. Это и обуславливает текучесть воды.
Такую структуру вода, по воззрению Колясникова, имеет исключительно в водянистом состоянии и, может быть, отчасти в парообразном. А вот во льду, кристаллическая структура, которого отлично исследована, тетрагидроли соединены меж собой негибкими равнопрочными прямыми водородными связями в ажурный каркас с большенными пустотами в нем, что делает плотность льда меньше плотности воды.
Когда же лед тает, часть водородных связей в нем слабеет и изгибается, что ведет к перестройке структуры в вышеперечисленные тетрамеры и делает водянистую воду более плотной, чем лед. При 4°С наступает состояние, когда все водородные связи меж тетрамерами очень изогнуты, чем и обуславливается максимум плотности воды при этой температуре. Далее связям гнуться некуда.
При температуре выше 4°С, утверждает Колясников, начинается разрывание отдельных связей меж тетрамерами, и при 36-37°С оказывается разорвана половина наружных водородных связей. Это и определяет минимум на кривой зависимости удельной теплоемкости воды от температуры. При температуре же 70°С разорваны уже практически все межтетрамерные связи, и наряду со свободными тетрамерами в воде остаются только недлинные клочки «полимерных» цепочек из их. В конце концов при кипении воды происходит окончательный разрыв сейчас уже одиночных тетрамеров на отдельные молекулы Н20. И то событие, что удельная теплота испарения воды ровно в 3 раза больше суммы удельных теплот плавления льда и следующего нагрева воды до 100°С, является доказательством догадки Колясникова о том. что число внутренних связей в тетрамере в 3 раза больше числа наружных.
Колясников считает, что такая тетраэдрально-винтовая структура воды обоснована ее старой реологической связью с кварцем и другими кремнекислородными минералами, преобладающими в земной коре, из недр которой когда-то появилась вода на Земле. Как небольшой кристаллик соли принуждает окружающий его раствор кристаллизоваться в подобные ему кристаллы, а не в другие, так кварц принудил молекулы воды выстраиваться в тетраэдрические структуры, которые, энергетически более прибыльны. А в нашу эру в земной атмосфере водяные пары, конденсируясь в капли, образуют такую структуру поэтому, что в атмосфере всегда находятся мелкие капельки аэрозольной воды, уже имеющей эту структуру. Они и являются центрами конденсации водяных паров в атмосфере.
Рис. Простый верный кремне-кислородный тетраэдр SiO44-.
Рис. Простые кремнекислородные единицы-ортогруппы SiO44- в структуре Mg-пироксена энстатите (а) и диортогруппы Si2 O76в Са-пироксеноиде волластоните (б).
Рис. Простые типы островных кремнекислородных анионных группировок: а-SiO4, б-Si2O7, в-Si3O9, г-Si4О12, д-Si6O18.
Рис. Важные типы кремнекислородных цепочечных анионных группировок (по Белову): а-метагерманатная, б — пироксеновая, в — батиситовая, г-волластонитовая, д-власовитовая, е-мелилитовая, ж-родонитовая, з-пироксмангитовая, и-метафосфатная, к-фторобериллатная, л — барилитовая.
Рис. Конденсация пироксеновых кремнекислородных анионов в ленточные двухрядные амфиболовые (а), трехрядные амфиболоподобные (б), слоистые тальковые и близкие им анионы (в).
Рис. Важные типы ленточных кремнекислородных группировок (по Белову): а — силлиманитовая, амфиболовая, ксонотлитовая; б-эпидидимитовая; в-ортоклазовая; г-нарсарсукитовая; д-фенакитовая призматическая; е-эвклазовая вкрапленная.
Рис. Кусок (простый пакет) слоистой кристаллической структуры мусковита KAl2(AlSi3O10XOH)2, иллюстрирующий переслаивание алюмокремне-кислородных сеток с полиэдрическими слоями больших катионов алюминия и калия.
В догадке Колясникова любопытно к тому же то, что из нее следует равновероятность существования право — и левовинтовой воды. Но биологами издавна подмечено, что в био тканях и структурах наблюдаются только или лево -, или правовинтовые образования. Пример тому — белковые молекулы, построенные только из лево-винтовых аминокислот и закрученные только по левовинтовой спирали. А вот сахара в живой природе — все только правовинтовые. Никто пока не сумел разъяснить, почему в живой природе находится такое предпочтение к левому в одних случаях и к правому — в других. Ведь в неживой природе с равной вероятностью встречаются как право-, так и левовинтовые молекулы.
Смеси сахаров в воде ведут себя очень любопытно. Их концентрацию определяют, измеряя угол поворота плоскости поляризации света при прохождении его через раствор. Она поворачивается поэтому, что молекулы сахара, как и большая часть молекул других органических соединений, представляют собой в пространстве спиральные либо квазиспиральные структуры, группы атомов в каких размещены по верхушкам тетраэдра. В сахаре, получаемом из свеклы либо тростника, молекулы завернуты почему-либо только по правовинтовой спирали. Потому-то плоскость поляризации света, проходящего через раствор такового сахара, поворачивается на право, и угол поворота находится в зависимости от концентрации сахара в растворе. Этот способ, открытый французским физиком Ж. Био еще в 1815 г., оказался совсем неприменимым для измерения концентрации смесей искусственного сахара, приобретенного синтетическим методом, ибо в том правои левовинтовые молекулы содержатся в равной мере.
Как еще в 1848 г. обосновал ставший позже известным французский бактериолог Луи Пастер, кристаллы этих 2-ух типов в искусственном сахаре реально отличить друг от друга под микроскопом и поделить, осторожно отбирая их пинцетом. Другой опыт с сахаром заключался в том, что его веществом кормили бактерии. Сахар, приобретенный из свеклы, бактерии съедали стопроцентно. А при питании искусственным сахаром они съедали только половинку. Раствор оставшейся половины поворачивал плоскость поляризации света уже в левом направлении. Бактерии не потребляли левовинтовой сахар! Но как они различают правовинтовой от левовинтового? Ответа у биологов до сего времени нет, как нет и ответа на вопрос, почему живым структурам присуща только определенная спиральность.
Догадка о структуре воды дает подсказку, что те клочки цепочек из тетрамеров, которые всегда имеются в водянистой воде, при ее резвом и неравномерном в пространстве течении должны выстраиваться и растягиваться повдоль линий тока воды, как растягиваются водные растения в реке повдоль ее течения. Другими словами их беспорядочное размещение сменяется на упорядоченное. При всем этом возможность того, что концы цепочек тетрамеров случаем столкнутся вместе и объединятся свободными водородными связями, растет в три раза по сопоставлению с неупорядоченным расположением. Это следует из законов геометрии. А любая вновь образованная водородная связь — это 0,26-0,5 эВ энергии, выделяющейся из воды.
Нужно сказать, что вода — не единственное вещество, способное создавать межмолекулярные водородные связи. Они свойственны и для многих органических соединений. А поэтому описанный процесс полимеризации в вихревом потоке должен происходить и при использовании заместо воды смесей органических соединений.
Это показывает на то, что вода — не единственная жидкость, которая может удачно работать в вихревых теплогенераторах. И вправду, опыты проявили, что и масла, и дизельное горючее тоже применимы для использования в качестве рабочего тела вихревого теплогенератора. Но вода и дешевле, и доступнее, и безопаснее в пожарном отношении. Ну и результаты, приобретенные при работе с ней, пока много лучше, чем при работе с другими жидкостями.
Итак, теория движения просит, чтоб вода, приводимая во вращение в вихре, изыскала возможность выделить в виде излучений часть собственной внутренней энергии, а эта вода, образуя в вихревом потоке новые межмолекулярные связи, сама отыскивает возможность выделить часть собственной внутренней энергии, чтоб появилась нужная отрицательная энергия связи!
См.продолжение в последующей статье веб-сайта.