 Вода обычная и необыкновенная
Вода обычная и необыкновенная
Вода обычная и необыкновенная
О.В.Мосин.
Вода — часто встречающееся вещество на Земле. 3/4 поверхности земного шара покрыты водой в виде океанов, морей, рек и озер. Много воды находится в газообразном состоянии в виде паров в земной атмосфере; в виде больших масс снега и льда на верхушках гор и в полярных странах. В недрах земли также находитcя вода, пропитывающая почву и горные породы.
Природная вода не бывает совсем незапятанной. Более незапятанной является талая и дождевая вода, да и она содержит малозначительные количества разных природных примесей. Количество примесей в пресных водах находится в границах от 0,01 до 0,1 % (масс.). Морская вода содержит 3,5% (масс.) растворенных веществ, главную массу которых составляет обычная поваренная соль.
Вода, содержащая существенное количество солей кальция и магния, именуется жесткой в отличие от мягенькой воды — дождевой. Жесткая вода уменьшает процесс пенообразования, а на стенах котлов образует накипь.
Чтоб очистить природную воду от взвешенных в ней частиц, ее фильтруют через слой пористого вещества, к примеру, активированного угля, керамзита, обожженной глины и др. При фильтровании огромных количеств воды пользуются фильтрами из песка и гравия. Фильтры задерживают также огромную часть микробов. Не считая того, для обеззараживания питьевой воды ее хлорируют; для полной стерилизации воды требуется менее 0,7 г хлора на 1 т воды.
Фильтрованием можно удалить из воды только нерастворимые примеси. Растворенные вещества убирают из нее методом перегонки (дистилляции) либо ионного обмена.
Вода имеет очень огромное значение в жизни растений, животных и человека. Происхождение жизни на Земле должно воде. В организме вода представляет собой среду, в какой протекают хим процессы, обеспечивающие жизнедеятельность организма; не считая того, вода учавствует в целом ряде биохимических реакций как растворитель.
Вода очень необыкновенная по своим физико-химическим свойствам субстанция. Плотность воды при переходе ее из твердого состояния в жидкое не миниатюризируется, как у других веществ, а растет. При нагревании воды от 0 до 4°С плотность ее также возрастает. При 4°С вода имеет наивысшую плотность, при предстоящем нагревании ее плотность миниатюризируется. Это свойство воды очень ценно для жизни. Если б при снижении температуры и при переходе из водянистого состояния в жесткое плотность воды изменялась, как это происходит у подавляющего большинства веществ, то при приближении зимы поверхностные слои природных вод охлаждались. бы до 0°С и опускались на дно, освобождая место более теплым слоям, и так длилось бы до того времени, пока вся масса водоема не заполучила бы температуру 0°С. Тогда бы вода замёрзла, образующиеся льдины погружались бы на дно и водоем промерзал бы на всю его глубину. Многие формы жизни в воде могли быть невозможны. Но потому что большей плотность вода добивается при 4 °С, то перемещение ее слоев, вызываемое остыванием, завершается при достижении этой температуры. При предстоящем снижении температуры охлажденный слой, владеющий наименьшей плотностью, остается на поверхности, леденеет и тем защищает лежащие ниже слои от предстоящего остывания и замерзания.
Огромное значение имеет тот факт, что вода. обладает аномально высочайшей теплоемкостью [4,18 Дж/(г К)]. Потому .в ночное время, также при переходе от лета к зиме вода остывает медлительно, а деньком либо при переходе от зимы к лету так же медлительно греется, являясь, таким макаром, регулятором температуры на земном шаре.
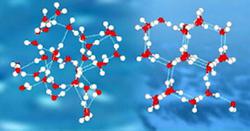 Набросок. Структура воды (слева) и льда (справа). В водянистой воде водородные связи нескольких примыкающих молекул образуют непостоянные, очень быстротечные структуры (слева). Во льду любая молекула воды жёстко связана с 4-мя другими (справа).
Набросок. Структура воды (слева) и льда (справа). В водянистой воде водородные связи нескольких примыкающих молекул образуют непостоянные, очень быстротечные структуры (слева). Во льду любая молекула воды жёстко связана с 4-мя другими (справа).
Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в верхушке — ядро атома кислорода, Межъядерные расстояния О—Н близки к 0,1 нм, расстояние меж ядрами атомов водорода равно 0,15 нм. Из восьми электронов, составляющих наружный электрический слой атома кислорода в молекуле воды две электрические пары образуют ковалентные связи О—Н, а другие четыре электрона представляют собой две неподеленных электрических пары.
Атом кислорода в молекуле воды находится в состоянии sp2-гибридизации. Потому валентный угол НОН (104,3°) близок к тетраэдрическому (109,5°). Электроны, образующие связи О—Н, сдвинуты к более электроотрицательному атому кислорода. В итоге атомы водорода получают действенные положительные заряды, так как на их создаются два положительных полюса. Центры отрицательных зарядов неподеленных электрических пар атома кислорода, находящиеся на гибридных — орбиталях, сдвинуты относительно ядра атома и в свою очередь делают два отрицательных полюса.
Молекулярная масса парообразной воды равна 18 ед. Но молекулярная масса водянистой воды, определяемая методом исследования ее смесей в других растворителях оказывается более, высочайшей. Это происходит из-за того, что в водянистой воде происходит ассоциация отдельных молекул воды в более сложные агрегаты (кластеры). Таковой вывод подтверждается и аномально высочайшими значениями температур плавления и кипения воды. Ассоциация молекул воды вызвана образованием меж ними водородных связей.
По собственной структуре вода представляет собой иерархию правильных больших структур, в базе которых лежит кристаллоподобные образования, состоящие из 57 молекул и взаимодействующие вместе за счет свободных водородных связей. Это приводит к возникновению структур второго порядка в виде шестигранников, состоящих из 912 молекул воды. Характеристики кластеров зависят от того, в каком соотношении выступают на поверхность кислород и водород. Конфигурация частей воды реагирует на хоть какое наружное воздействие и примеси, что разъясняет очень лабильный нрав их взаимодействия. В обыкновенной воде совокупа отдельных молекул воды и случайных ассоциатов составляет 60% (деструктурированная вода), а 40% — это кластеры (структурированная вода).
В жесткой воде (лед) атом кислорода каждой молекулы участвует в образовании 2-ух водородных связей с примыкающими молекулами воды. Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются вместе своими разноименными полюсами. Молекулы образуют слои, при этом любая из их связана с 3-мя молекулами, принадлежащими к тому же слою, и с одной — из примыкающего слоя. Структура льда принадлежит к менее плотным структурам, в ней есть пустоты, размеры которых несколько превосходят размеры молекулы.
При плавлении льда его структура разрушается. Да и в водянистой воде сохраняются водородные связи меж молекулами: образуются ассоциаты — осколки структур льда, — состоящих из большего либо наименьшего числа молекул воды. Но в отличит от льда каждый ассоциат существует очень куцее время: повсевременно происходит разрушение одних и образование других агрегатов. В пустотах таких “ледяных” агрегатов могут располагаться одиночные молекулы воды; при всем этом упаковка молекул воды становится более плотной. Вот поэтому при плавлении льда объем, занимаемый водой, миниатюризируется, а ее плотность растет.
По мере нагревания воды обломков структуры льда в ней становится меньше, что приводит к предстоящему увеличению плотности воды. В интервале температур от 0 до 4°С этот эффект преобладает над термическим расширением, так что плотность воды продолжает возрастать. Но при нагревании выше 4°С преобладает воздействие усиления термического движения молекул и плотность воды миниатюризируется. Потому при 4°С вода обладает наибольшей плотностью.
При нагревании воды часть теплоты затрачивается на разрыв водородных связей (энергия разрыва водородной связи в воде составляет приблизительно 25 кДж/моль). Этим разъясняется высочайшая теплоемкость воды. Водородные связи меж молекулами воды стопроцентно разрываются только при переходе воды в пар.
Диаграмма состояния воды (либо фазовая диаграмма) представляет собой графическое изображение зависимости меж величинами, характеризующими состояние системы, и фазовыми превращениями в системе (переход из твердого состояния в жидкое, из водянистого в газообразной и т. д.). Для однокомпонентных систем обычно употребляются диаграммы состояния, показывающие зависимость фазовых перевоплощений от температуры и давления; они именуются диаграммами состояния в координатах Р—Т.
На рисунке приведена диаграмма состояния воды. Хоть какой точке на диаграмме отвечают определенные значения температуры и давления.
Диаграмма указывает те состояния воды, которые термодинамически устойчивы при определенных значениях температуры и давления. Она состоит из 3-х кривых, разграничивающих все вероятные температуры и давления на три области, отвечающие льду, воды и пару.
Разглядим каждую из кривых более тщательно. Начнем с кривой ОА, отделяющей область пара от области водянистого состояния. Представим для себя цилиндр, из которого удален воздух, после этого в него введено некое количество незапятанной, свободной от растворенных веществ, в том числе от газов, воды; цилиндр обеспечен поршнем, который закреплен в неком положении. Через некое время часть воды улетучится и над ее поверхностью будет находиться насыщенный пар. Можно измерить его давление и убедиться в том, что оно не меняется со временем и не находится в зависимости от положения поршня. Если прирастить температуру всей системы и вновь измерить давление насыщенного пара, то окажется, что оно возросло. Повторяя такие измерения при разных температурах, найдем зависимость давления насыщенного водяного пара от температуры. Кривая ОА представляет собой график этой зависимости: точки кривой демонстрируют те пары значений температуры и давления, при которых водянистая вода и водяной пар находятся в равновесии вместе — сосуществуют. Кривая ОА именуется кривой равновесия жидкость—пар либо кривой кипения. В таблице приведены значения давления насыщенного водяного пара при нескольких температурах.
Попытаемся выполнить в цилиндре давление, хорошее от сбалансированного, к примеру, наименьшее, чем сбалансированное. Для этого освободим поршень и поднимем его. В 1-ый момент давление в цилиндре, вправду, свалится, но скоро равновесие восстановится: улетучится дополнительно некое количество воды и давление вновь достигнет сбалансированного значения. Только тогда, когда вся вода улетучится, можно выполнить давление, наименьшее, чем сбалансированное. Отсюда следует, что точкам, лежащим на диаграмме состояния ниже либо правее кривой ОА, отвечает область пара. Если пробовать сделать давление, превышающее сбалансированное, то этого можно достигнуть, только опустив поршень до поверхности воды. По другому говоря, точкам диаграммы, лежащим выше либо левее кривой ОА, отвечает область водянистого состояния.
До каких пор простираются на лево области водянистого и парообразного состояния? Наметим по одной точке в обеих областях и будем двигаться от их горизонтально на лево. Этому движению точек на диаграмме отвечает остывание воды либо пара при неизменном давлении. Понятно, что если охлаждать воду при обычном атмосферном давлении, то при достижении 0°С вода начнет леденеть. Проводя подобные опыты при других давлениях, придем к кривой ОС, отделяющей область водянистой воды от области льда. Эта кривая — кривая равновесия жесткое состояние — жидкость, либо кривая плавления,— указывает те пары значений температуры и давления, при которых лед и водянистая вода находятся в равновесии.
Двигаясь по горизонтали на лево в области пара (в нижнею части диаграммы), аналогичным образом придем к кривой 0В. Это—кривая равновесия жесткое состояние—пар, либо кривая сублимации. Ей отвечают те пары значений температуры к давления, при которых в равновесии находятся лед и водяной пар.
Все три кривые пересекаются в точке О. Координаты этой точки—это единственная пара значений температуры и давления,. при которых в равновесии могут находиться все три фазы: лед, водянистая вода и пар. Она носит заглавие тройной точки.
Кривая плавления изучена до очень больших давлений, В этой области найдено несколько модификаций льда (на диаграмме не показаны).
Справа кривая кипения оканчивается в критичной точке. При температуре, отвечающей этой точке,—критичной температуре— величины, характеризующие физические характеристики воды и пара, становятся схожими, так что различие меж водянистым и парообразным состоянием исчезает.
Существование критичной температуры установил в 1860 г. Д. И. Менделеев, изучая характеристики жидкостей. Он показал, что при температурах, лежащих выше критичной, вещество не может находиться в водянистом состоянии. В 1869 г. Эндрьюс, изучая характеристики газов, пришел к аналогичному выводу.
Критичные температура и давление для разных веществ различны. Так, для водорода = —239,9 °С, = 1,30 МПа, для хлора =144°С, =7,71 МПа, для воды = 374,2 °С, =22,12 МПа.
Одной из особенностей воды, отличающих ее от других веществ, является снижение температуры плавления льда с ростом давления. Это событие отражается на диаграмме. Кривая плавления ОС на диаграмме состояния воды идет ввысь на лево, тогда как практически для всех других веществ она идет ввысь на право.
Перевоплощения, происходящие с водой при атмосферном давлении, отражаются на диаграмме точками либо отрезками, расположенными на горизонтали, отвечающей 101,3 кПа (760 мм рт. ст.). Так, плавление льда либо кристаллизация воды отвечает точке D, кипение воды—точке Е, нагревание либо остывание воды — отрезку DE и т. п.
Диаграммы состояния исследованы для ряда веществ, имеющих научное либо практическое значение. В принципе они подобны рассмотренной диаграмме состояния воды. Но на диаграммах состояния разных веществ могут быть особенности. Так, известны вещества, тройная точка которых лежит при давлении, превосходящем атмосферное. В данном случае нагревание кристаллов при атмосферном давлении приводит не к плавлению этого вещества, а к его сублимации — превращению жесткой фазы конкретно в газообразную.
Молекулы воды отличаются большой устойчивостью к нагреванию. Но при температурах выше 1000 °С водяной пар начинает распадаться на составляющие воду водород и кислород. Процесс разложения вещества в итоге его нагревания именуется тепловой диссоциацией. Тепловая диссоциация воды протекает с поглощением теплоты. Потому, согласно принципу равновесия французского учёного Ле Шателье, чем выше температура, тем в основном разлагается вода. Но даже при 2000 °С степень тепловой диссоциации воды не превосходит 2%, т.е. равновесие меж газообразной водой и продуктами ее диссоциации — водородом и кислородом — все еще остается сдвинутым в сторону воды. При охлаждении же ниже 1000 °С равновесие фактически стопроцентно двигается в этом направлении.
Вода — очень реакционноспособное вещество. Оксиды многих металлов и неметаллов соединяются с водой, образуя основания и кислоты; некие соли образуют с водой кристаллогидраты; более активные металлы ведут взаимодействие с водой с выделением водорода.
Вода обладает также каталитической способностью. В отсутствие следов воды фактически не протекают некие обыденные реакции; к примеру, хлор не ведет взаимодействие с металлами, фтороводород не разъедает стекло, натрий не окисляется в атмосферы воздуха.
Вода способна соединяться с рядом веществ, находящихся при обыденных критериях в газообразном состоянии, образуя при всем этом так: именуемые гидраты газов. Примерами могут служить соединения ксенона, хлора и углеводородов, которые выпадают в виде кристаллов при температурах от 0 до 24 °С (обычно при завышенном давлении соответственного газа). Подобные соединения появляются в итоге наполнения молекулами газа (“гостя”) межмолекулярных полостей, имеющихся в структуре воды (“владельца”); они именуются соединениями включения либо клатратами.
В клатратных соединениях меж молекулами “гостя” и “владельца” образуются только слабенькие межмолекулярные связи; включенная молекула не может покинуть собственного места в полости кристалла в большей степени из-за пространственных затруднений Потому клатраты — неуравновешенные соединения, которые могут существовать только при сравнимо низких температурах.
Клатраты употребляют для разделения углеводородов и великодушных газов. В ближайшее время образование и разрушение клатратов газов (пропана и неких других) удачно применяется для обессоливания воды. Нагнетая в соленую воду при завышенном давлении соответственный газ, получают льдоподобные кристаллы клатратов, а соли остаются в растворе. Похожую на снег массу кристаллов отделяют от маточного раствора и промывают, Потом при неком повышении температуры либо уменьшении давления клатраты распадаются, образуя пресную воду и начальный газ, который вновь употребляется для получения клатрата. Высочайшая экономичность и сравнимо мягенькие условия воплощения этого процесса делают его многообещающим в качестве промышленного способа опреснения морской воды.
При электролизе обыкновенной воды, содержащей вместе с обыкновенными молекулами воды также появляется малозначительное количество молекул тяжёлой и полутяжёлой НОD воды, образованных томным изотопом водорода. Потому при продолжительном электролизе воды остаток равномерно обогащается молекулами этих соединений. Из такового остатка после неоднократного повторения электролиза учёным в 1933 г. в первый раз удалось выделить маленькое количество воды состоящей практически на 100% из молекул дейтерия и получившей заглавие тяжеленной.
По своим свойствам томная вода приметно отличается от обыкновенной воды. Реакции с тяжеленной водой протекают медлительнее, чем с обыкновенной, константы диссоциации молекулы тяжёлой воды меньше таких для обыкновенной воды. Томную воду используют в качестве замедлителя нейтронов в ядерных реакторах. Из-за высочайшей энергоемкости производства из природного сырья её цена составляет 200–250 баксов за 1 кг. После распада СССР в Рф создание тяжёлой воды отсутствует. В то же время в стране накопилось существенное количество разбавленной тяжеленной воды, грязной тритием за счёт деятельности атомных АЭС. Также имеется необходимость переработки снятых с вооружения боеприпасов, в процессе которой образуются тяжеловодные отходы. Эти отходы могут служить сырьем для получения тяжеленной воды.
Русскими учёными из ПИЯВ разработаны на опытнейших установках уникальные технологии получения и чистки тяжеленной воды. В 1995 была введена в эксплуатацию 1-ая в Рф и одна из первых в мире опытно-промышленная установка на базе способа изотопного обмена в системе вода-водород и электролиза воды (ЭВИО).
Высочайшая эффективность установки ЭВИО дает возможность получать томную воду с содержанием дейтерия > 99,995 % ат. Отработанная в ПИЯФ разработка обеспечивает высочайшее качество тяжеленной воды, включая глубокую чистку тяжеленной воды от трития до остаточной активности, позволяющей без ограничений использовать томную воду в мед и научных целях. Способности установки позволяют стопроцентно обеспечить потребности русских компаний и организаций в тяжеленной воде и дейтерии, также экспортировать часть продукции. За время работы для нужд Росатома и других компаний Рф были произведены более 20 тонн тяжёлой воды и 10-ки кг газообразного дейтерия.
Черта свойства изотопной продукции получаемой на установках ПИЯФ
Вода с пониженным содержанием изотопа дейтерия Наименее 10-3% (более чем на порядок ниже, чем в природной воде) Определяется требованиями заказчика < 1 Бк/кг
(ниже, чем в природной воде) .
При эксплуатации тяжеловодных реакторов тяжёлая вода загрязняется протием, к примеру, при натекании паров воды из атмосферы, а тритий появляется в тяжеленной воде вследствие захвата нейтронов атомами дейтерия. Разрабатывается проект установки изотопной чистки тяжеленной воды из реакторов атомных АЭС. При помощи этой установки содержание трития в тяжеленной воде должно поддерживаться на уровне 7,4•1010Бк/кг тяжёлой воды, а изотопная концентрация тяжеленной воды не ниже, чем 99,8 % тяжёлой воды.