 Выделение изотопномеченых аминокислот из белковых гидролизатов микробов
Выделение изотопномеченых аминокислот из белковых гидролизатов микробов
Выделение изотопномеченых аминокислот из белковых гидролизатов микробов
Биомасса микробов, выращенных на средах, содержащих постоянные изотопы, является ценным источником разных изотопномеченых БАС, в том числе аминокислот. При всем этом более распространённым и обычным способом препаративного выделения аминокислот из клеточной биомассы является её гидролиз с внедрением ферментативных либо хим способов и следующая ионообменная хроматография на катионои анионообменных смолах (дауэкс, амберлит, пермутит, аминекс, дуолит и др.) [133]. Огромное значение при проведении гидролиза белка имеет выбор того либо другого гидролизирующего агента, который определяется целью исследования.
Ферментативное расщепление протеолитическими ферментами может протекать ступенчато с концов молекулы (экзопептидазами) либо оковём расщепления специфичных отдельных пептидных связей полипептидной цепи (эндопептидазами), причём специфика находится в зависимости от конфигурации, аминокислотной последовательности и конформации белка [134]. Для селективного хим расщепления белков создано сильно много способов [135], посреди которых есть некоторое количество способов расщепления по ?-углеродному атому (к примеру, через остатки дегидроаланина). Щёлочи и кислоты владеют высочайшей гидролизующей способностью и потому их внедрение приводит к разрушению неких аминокислот и к изотопному обмену в триптофане, тирозине и гистидине и в неких других аминокислотах.
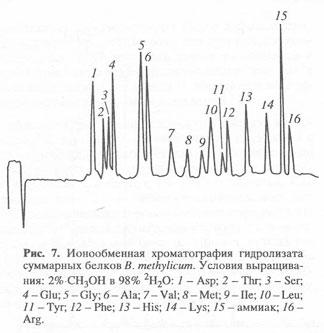
В критериях щелочного гидролиза (4 н. Ba(OH)2 либо NaOH, 24 ч, 1100) реакций изотопного обмена водорода на дейтерий фактически не наблюдается (исключением является протон (дейтерон) у атома С2’ гистидина) [136].
Значимым недочетом щелочного гидролиза, лимитирующим его внедрение, является значимая рацемизация аминокислот. Потому для препаративных целей щелочной гидролиз употребляется очень изредка, в то время как кислотный — очень обширно. Кислотный гидролиз в стандартных критериях (6 н. НCl либо 8 н. Н2SO4, 24 ч, 1100), как понятно, приводит к полному разрушению триптофана и частичному разрушению серина, треонина и неких других аминокислот [137]. Добавление в обскурантистскую среду оксибензола [138], тиогликолевой кислоты [139], ?-меркаптоэтанола [140], позволяет сохранить до 80-85% триптофана. Не считая этого, в критериях кислотного гидролиза с высочайшей скоростью протекает изотопный обмен ароматичных протонов (дейтеронов) в молекулах триптофана, тирозина и гистидина [141], также протонов (дейтеронов) при атоме С3 аспарагиновой и С4 глутаминовой кислот [142]. Потому для получения реальных данных о биосинтетическом включении дейтерия в белок рекомендуется проводить кислотный гидролиз в присутствии дейтерированных реагентов. Этим методом могут быть выделены и анализированы с внедрением ионообменной хроматографии большая часть аминокислот в составе гидролизатов белка (рис. 3). Так, с помощью ионообменной хроматографии были препаративно выделены [2H], [13C]и [15N]аминокислоты из белковых гидролизатов различных природных источников с выходами личных аминокислот от 77% до 95% и с уровнями изотопного включения, превосходящими 95% [143]. Но, способ выделения аминокислот из гидролизатов биомассы, будучи обширно применяем на практике нередко просит использования вредных буферных смесей (ацетат, формиат, пиридин и др.), нескольких колонок с следующей рехроматографией для полного выделения незапятнанных аминокислот из гидролизатов биомассы.
 Условия ионообменного выделения [2H]аминокислот из гидролизатов суммарных белков биомассы микроводоросли Scenedesmus obliquus, состав элюирующих растворителей, время проведения хроматографического анализа и др, были изучены в работе [144]. При всем этом, уровни изотопного включения дейтерия в аминокислоты, выделенные из гидролизатов белков Scenedesmus obliquus составили более 98%. Вследствие протекания реакций оборотного изотопного (1Н-2Н)-обмена с протонированным растворителем в процессе элюирования [2H]аминокислот с сорбента, протоны в ?-положении аспарагиновой кислоты и ?-положении глутаминовой кислоты были обогащены дейтерием на 90%, т. е. ниже, чем для других аминокислот. Подвижные атомы дейтерия в ?-положении имидазольного кольца молекулы гистидина и атомы дейтерия при гетероатоме азота в индольном кольце триптофана также просто обменивались на протоны в составе аква растворителей при выделении аминокислот.
Условия ионообменного выделения [2H]аминокислот из гидролизатов суммарных белков биомассы микроводоросли Scenedesmus obliquus, состав элюирующих растворителей, время проведения хроматографического анализа и др, были изучены в работе [144]. При всем этом, уровни изотопного включения дейтерия в аминокислоты, выделенные из гидролизатов белков Scenedesmus obliquus составили более 98%. Вследствие протекания реакций оборотного изотопного (1Н-2Н)-обмена с протонированным растворителем в процессе элюирования [2H]аминокислот с сорбента, протоны в ?-положении аспарагиновой кислоты и ?-положении глутаминовой кислоты были обогащены дейтерием на 90%, т. е. ниже, чем для других аминокислот. Подвижные атомы дейтерия в ?-положении имидазольного кольца молекулы гистидина и атомы дейтерия при гетероатоме азота в индольном кольце триптофана также просто обменивались на протоны в составе аква растворителей при выделении аминокислот.
[13C]аминокислоты были выделены из гидролизатов суммарных белков биомассы штамма метаногенных микробов Methanobacterium espanolae при росте микробов на [1-13C]и [2-13C]ацетате с уровнями включения 13С в молекулы аминокислот до 90% [145]. Согласно цитируемым там данным, наименее 2% случайной метки в молекулах аминокислот были распределены меж атомами углерода в позициях, происходящих из 13С карбоксильной либо метильной группы ацетата и еще наименьший процент включения метки детектировался в положениях углеродного скелета молекул, образованных из 13СО2.
Большой практический энтузиазм представляет реализация преимуществ препаративной обращенно-фазовой высокоэфективной жидкостной хроматографии (ОФ ВЭЖХ) при получении оптически незапятнанных меченых аминокислот и их N-производных в количествах, нужных для биоаналитических и синтетических целей [146, 147]. Так, в работе [147] описан способ препаративного выделения личных аминокислот из разных микробиологических источников при помощи ОФ ВЭЖХ в виде бензилоксикарбонильных производных (N-Cbz производных) аминокислот. Разработанный способ позволяет выделять аминокислоты с высочайшим выходом (от 67% до 89%) и хроматографической чистотой (96-99%) [147] и может быть применен для выделения [2H]-, [13C]-, [15N] и [18O]аминокислот из белковых гидролизатов разных источников.