 Роль электрода в процессе катализа
Роль электрода в процессе катализа
Из практики известен ряд определенных материалов, которые могут использоваться в качестве катализаторов для некоторых реакций. Учитывая чрезвычайную сложность обобщенного описания явления, авторы сочли возможным остановиться на квантово-механической интерпретации наиболее простого случая — реакции разряда водорода на различных металлах. Из экспериментов известно, что наилучшими катализаторами для водорода являются переходные металлы. Плотность тока обмена Jo связана с энергией хемосорбции водорода. При этом металлы условно разделяются на три группы.
Для металлов первой группы (в частности, Hg и РЬ) скорость реакции определялась скоростью разряда иона водорода:
, медленно
,Н+ + е——— — НаЛ,
|
|
 |
|
 |
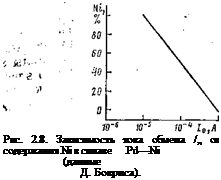 Было высказано несколько гипотез о причине воздей — .ствпя катализатора на скорость реакции водорода (ионизацию). Особенно характерны исследования по сплавам металлов. Так, при изучении золото-платинового сплава было установлено, что ток обмена водородной реакции уменьшается с изменением содержания золота и достигает минимума при 60% Аи. При таком составе оказываются заполненными все d-связи. Для сплава платина—палладий отмечалась зависимость между прочностью связи атом водорода — металл и составом сплава. Интересные зависимости от геометрических факторов структуры металла были получены при изучении сплава никель— палладий. Палладий и никель имеют близкую электронную структуру, но разные размеры атомов. Учитывая, что энергия активации выше при больших размерах решетки (палладий), можно было ожидать увеличения тока обмена с уменьшением содержания никеля (меньшие размеры решетки). Экспериментально подтверждена такая зависимость (рис. 2.8). Заметим, что эти исследования носят чисто качественный характер, поскольку дефекты, неизбежно существующие на поверхности реальных тел, искажают параметры решетки и
Было высказано несколько гипотез о причине воздей — .ствпя катализатора на скорость реакции водорода (ионизацию). Особенно характерны исследования по сплавам металлов. Так, при изучении золото-платинового сплава было установлено, что ток обмена водородной реакции уменьшается с изменением содержания золота и достигает минимума при 60% Аи. При таком составе оказываются заполненными все d-связи. Для сплава платина—палладий отмечалась зависимость между прочностью связи атом водорода — металл и составом сплава. Интересные зависимости от геометрических факторов структуры металла были получены при изучении сплава никель— палладий. Палладий и никель имеют близкую электронную структуру, но разные размеры атомов. Учитывая, что энергия активации выше при больших размерах решетки (палладий), можно было ожидать увеличения тока обмена с уменьшением содержания никеля (меньшие размеры решетки). Экспериментально подтверждена такая зависимость (рис. 2.8). Заметим, что эти исследования носят чисто качественный характер, поскольку дефекты, неизбежно существующие на поверхности реальных тел, искажают параметры решетки и
(И
влияют на каталитические процессы (см. § 3.5). Исследования на монокристаллах металлов подтверждают зависимость реакции выделения водорода от параметров решетки. За последние годы появились более глубокие теории для объяснения роли материала электрода в процессе катализа. Продемонстрируем возможности современных методов на одном примере. Было высказано предположение, что различия в каталитической активности металлов, сплавов и диэлектриков тесно связаны с различиями в их электронной структуре и обусловлены ими. Отвлекаясь вначале от изменений, вносимых в электронную структуру металла его поверхностью, влиянием электролита, дефектами решетки и т. и., на примере простейшей реакции ионизации атома водорода
H-vH+ + e — (2.44)
была сделана попытка [2.7] выявить те параметры электронной структуры, которые определяют «ряд каталитической активности» металлов по отношению к данной реакции, а также по отношению к реакции гидрирования, поскольку в реакциях гидрирования часто именно стадия (2.44) является лимитирующей. Выявленные параметры в свою очередь могут стать основой более полной электронной теории катализа на металлах.
Рассмотрим задачу об энергетическом спектре атома водорода, внедренного в металл. Пренебрегая кристаллическим потенциалом и считая, что он целиком экранируется электронами проводимости металла, запишем эффективное уравнение Шредингера в виде
{-Ы +’ф(0} U (r)= EU(г). (2.45)
Здесь т — масса «голого» электрона; Ф(г) —экранированный кулоновский потенциал протона. Предполагается, что рассматриваемая задача обладает сферической симметрией.
Как известно, в зависимости от параметров потенциалов Ф(г) могут реализоваться два случая: либо энергетический спектр Е является непрерывным, либо существуют еще и дискретные уровни. В первом случае электрон коллективизируется, а металлы, способствующие ионизации атома водорода, называются нами катализаторами данной реакции.
Электронная структура металла аппроксимируется системой изотропных s- и d-зон. Статическую относи — 5-93 65
тельную диэлектрическую проницаемость можно представить в виде
+8rss + f5rdd~bBrsd~bCrds> (2.46)
где Erij описывает вклад в єг за счет г—/ переходов.
В Приближении свободных электронов Srss имеет вид
Здесь k—qaB, q—волновое число, аБ—боровский pa — ! диус; xs{EF)=Ns(EF)a2Be2; Ns — плотность электронных состояний на поверхности Ферми в s-зоне; е — заряд электрона. Для простых металлов ег(&)=1 +erss(k). Экранированный кулоновский потенциал Ф(г) определяется формулой
СО
-с, 2е2 С sin kr’ j f /г> л
, *(r) = —ZF)k^Wdk — (2-48)
Поведение Ф(г) при малых г (порядка нескольких десятых долей нанометра) определяется поведением er(k) при больших /г:
«Л%.о. = (т)’’■<£,)( (2-49)
Расчеты на ЭВМ показали, что и для г^>аБ потенциал Ф(г) хорошо (с точностью до нескольких процентов) аппроксимируется своим значением для малых г.
Главный вклад в &r<id дают переходы из незаполненной d-зоны в незаполненную. Ограничиваясь рассмотрением лишь одной незаполненной до конца d-зоны (именно так обстоит дело в случае Ni, Pd, Pt), выражение для Erdd(k) при принятых предположениях запишем в виде
![]() 1 ■ ід ^ ±1 п
1 ■ ід ^ ±1 п
1 4kdFk 2kdF — k\-
(2.50)
Здесь xd(EF) — плотность состояний реального металла на поверхности Ферми в d-зоне; UkdF — импульс Ферми d-электронов. Матричный элемент Mdd определяется перекрытием волновых функций d-электронов решетки металла. Приближенно в интересующей нас области волновых чисел k—kF можно принять Мм2^. Необходи — 66
мо подчеркнуть, что точное выражение для Єг анизотропного металла в пределе малых k дает именно плотность состояний на уровне Ферми. Эта плотность состояний введена в формулы (2.47) и (2.50), что означает фактический учет анизотропии реального металла.
Для переходных металлов вклады еш и erds в диэлектрическую проницаемость ег малы — порядка нескольких процентов, поэтому мы ими пренебрегаем. Для благородных металлов вклад erds существен н его можно оценить по формуле
где tiis — эффективная масса электронов проводимости; значения параметров /с и k& для Си, Ag, Аи можно найти в [2.8].
С учетом сказанного, подставляя асимптотическое значение еr{k) при й-мх> в выражение для экранированного кулоновского потенциала, получаем
ф(г)=—е2г~1 ехр (—aR) cos (аR). ‘
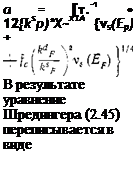 |
Здесь R=2qsFr параметр а имеет вид ^
{ш*+т cos № + ■с)и № = °- (-53)
где через a=(kaF)~x обозначен второй существенный (наряду с а) параметр.
Итак, исходя из определенной модели электронной структуры металлов мы установили, что экранированный кулоновский потенциал зависит от двух безразмерных параметров а и а.
Плотности состояний брались из расчетов зонной структуры реальных анизотропных металлов. В тех случаях, когда расчеты зонной структуры не вполне надежны или отсутствуют, суммарная плотность состояний находилась из электронной теплоемкости металлов, причем учитывались электрон-фононное и электрон-парамагнон — 5* 67
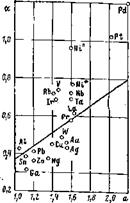
Рис. 2.9. Зависимость параметров а и а
для ряда металлов.
 ное взаимодействия. Импульс Ферми электронов находился по формуле qiF= [Зл2,/П]|/3, где г, — число электронов в і-зоне; Q — объем элементарной ячейки.
ное взаимодействия. Импульс Ферми электронов находился по формуле qiF= [Зл2,/П]|/3, где г, — число электронов в і-зоне; Q — объем элементарной ячейки.
В зависимости от отношения параметров а/а при решении уравнения Шредингера (2.53) реализуются две возможности. Количественный критерий, который позволял бы различать эти две возможности, можно получить следующим образом.
Известно, что для данного потенциала Ф(я, a, R) существует критическое значение £кр параметра ; =
00
=JФ(a, a-, R)RdR, такое, что при ij<£Kp спектр являет-
0
ся сплошным. Используя результаты численного расчета
[2.9] , получаем ^ (а/а)^ = 0,362.
Таким образом, в координатах а, а существует критическая линия — прямая. Все металлы, для которых параметры электронной структуры Vi (EF), k’F таковы, что а/а>0,362, относятся к первой группе. Они названы катализаторами реакции. Металлы, для которых а/а< <0,362, относятся ко второй группе; они не являются катализаторами. Распределение металлов по группам показано на рис. 2.9. К первой группе относятся известные катализаторы реакций гидрирования, такие как Pt, Pd, Ir, Rh, Ni. Качественно их принадлежность к этой группе определяется тем, что они имеют очень высокую плотность состояний на уровне Ферми в d-зоне а(Е) по сравнению с другими металлами.
Поскольку энергия связи атомов, молекул, твердых тел имеет электромагнитную природу, то подход к явлениям сорбции и катализа с точки зрения электромагнитных характеристик вещества (таких как диэлектрическая проницаемость) является правомочным и, по-видимому, перспективным.
Существуют такие параметры Vi(EF), k‘F, характерн
ее
зующие электронную структуру реального металла, которые позволяют в соответствии с принятым ранее определением выявить металлы — катализаторы реакции окисления водорода.
Проведенный анализ явился лишь демонстрацией возможностей метода, поскольку не учитывалось существование поверхности, влияние электролита [в первом приближении это можно сделать, приняв, что влияние электролита и поверхности сводится к изменению параметров i(EF), k‘F в приповерхностном слое]. Очевидно, что отношение ajа зависит от потенциала электрода, типа электролита и как следствие от концентрации электронов в приповерхностном слое.
Существенную роль на кинетику процесса оказывает экранирование поверхности. В рамках некоторых допущений показано, что понижение энергии активации из-за экранирования пропорционально параметру у:
Y = ____________________ (2 54)
1 1 + (2УЭф-/Эф)М^)/2 ‘ ‘
Здесь ‘s(Ef)—локальная плотность состояний
(ЛПС) в поверхностном узле і на поверхности Ферми;
vs(EF)=2ImG0(E—і’е, і, і) Iл; (2.55)
Go(E—і’є, і, і) —функция Грина невозмущенного металла; Iэф и УЭф — эффективные параметры обмена и отталкивания на узел с учетом корреляционных эффектов. В объеме металлов ЛПС совпадает с определенной ранее объемной ПЛОТНОСТЬЮ СОСТОЯНИЙ Vad(EF) и не зависит от положения узла І. Если узел і расположен на поверхности, ТО, вообще говоря, s(EF)^V, m{EF), В этом случае Vs (Ef) несет информацию как об электронном спектре всего металла, так и о локальных свойствах, вблизи поверхности, что снимает противоречие между «коллективным» и «локальным» подходами к поверхностным взаимодействиям. Однако с хорошей точностью можно оценить vs (Ef)^v05 (Ef) . Так как параметр Уэф. имеет порядок 1 эВ, а /Эф^0,6-^0,7 эВ, то у в основном определяется плотностью состояний на уровне Ферми,, что подтверждает результаты анализа. Экранирование — «металлическими», электронами влияет и на энергию — активации реакций переноса заряда на границе металл— растворитель полярная жидкость. В результате-
экранирования энергия активации уменьшается, причем это уменьшение пропорционально параметру у. Физический смысл этого эффекта следующий. Поскольку степени свободы растворителя образуют медленную подсистему (см. выше), член в гамильтониане, ответственный за взаимодействие с быстрой подсистемой (электронами), представляет собой статический одноэлектронный потенциал, зависящий от обобщенных координат медленной подсистемы. Экранирование этого потенциала при движении медленной подсистемы приводит к некоторому изменению термов и уменьшению полной энергии активации. Иными словами, электронная плотность подстраивается под каждое новое положение медленной подсистемы так, что изменение энергии быстрой подсистемы (электрон) при переходе медленной подсистемы (растворитель) к этому новому положению является минимальным.
Получить аналогичные соотношения для других рабочих компонент, более сложных, чем водород (кислород, углеводород, воздух и т. д.), пока еще не представляется возможным.