 ХИМИЧЕСКИЕ РЕАГЕНТЫ
ХИМИЧЕСКИЕ РЕАГЕНТЫ
Для приготовления промывочных жидкостей применяются разные по составу глины и вода, в связи с чем свойства растворов могут быть весьма разнообразными.
Кроме того, в процессе бурения под действием солей, присутствующих в подземных водах, и частиц выбуренной породы параметры промывочных жидкостей существенно меняются. Для придания раствору определенных технологических свойств, отвечающих требованиям конкретных геологических условий, промывочные жидкости обрабатывают различными химическими реагентами.
Химические реагенты могут вызвать;пептизацию или расщепление глинистых частиц и повысить коллоидальность глинистого раствора. Они влияют на их стабильность, процесс структурообразования, повышают устойчивость растворов к действию минеральных солей и регулируют процесс коагуляции.
Регулирование свойств глинистых растворов основано на двух главных принципах:
изменение физико-химического состояния дисперсной системы, свойств поверхности раздела твердой и жидкой фазы; изменение состава и концентрации твердой фазы. Изменение состояния дисперсной системы достигается вводом в глинистый раствор соответствующих химических реагентов, а регулирование состава и концентрации дисперсной фазы — разбавлением водой, механическим удалением части твердой фазы, вводом специальных добавок без изменения физико-химического состояния дисперсной системы.
Для регулирования состояния и свойств глинистых растворов применяют химические реагенты двух групп по химической природе: неорганические реагенты — электролиты и органические реагенты — защитные коллоиды.
Краткая характеристика и действие наиболее часто применяемых химических реагентов-электролитов приводятся ниже:
Кальцинированная сода (карбонат натрия — На2С03) представляет собой белый порошок, хорошо растворимый в воде, плотностью 2,53 г/см3. Перед вводом в промывочную жидкость порошок предварительно растворяют в воде, но возможен ввод в сухом виде.
Назначение:
связывание двухвалентных катионов, поступающих в раствор при перебуривании гипса, ангидрита, цемента или с пластовой минерализованной водой;
улучшение свойств глинистых растворов, приготовленных из местных глин невысокого качества;
повышение качества глинопорошков из небентонитовых глин, увеличение выхода глинистого раствора; увеличение щелочности глинистого раствора.
При вводе кальцинированной соды в раствор из кальциевой глины анионы С<Э23~ взаимодействуют с катионами Са2+, образуя диффузный слой. Образуется нерастворимый карбонат кальция:
Са2+ + СО2" -> СаСОэ.
На поверхности глинистых частиц адсорбируются катионы Иа+, т. е. идет катионный обмен, которому способствуют анионы СО з’ , а глина из кальциевой превращается в натриевую:
Са — глина + Ыа2С03-»СаС03 + N3 — глина.
Это способствует увеличению толщины диффузного слоя катионов, улучшению гидратации глины и агрегативной устойчивости глинистой суспензии.
При обработке глинистой суспензии, загрязненной сульфатом кальция (гипс, ангидрит), анионы СОз~ связывают агрессивные катионы кальция:
СаБО* + Ыа2С03->СаС03 + №2504.
Продукты реакции не влияют на свойства глинистой суспензии. При разбуривании цемента гидроксид кальция вызывает коагуляцию раствора, которую можно избежать путем обработки кальцинированной содой:
Са(ОН)2 + Ыа2С03 -> СаСОэ + №ОН.
То же происходит при попадании в раствор хлоридов кальция из минерализованных вод:
СаС12 + Иа2СОз -> СаСОэ + ИаС1.
Каустическая сода (гидроксид натрия — ИаОН) применяется для обработки почти всех видов промывочных жидкостей на водной основе. Это твердое вещество белого цвета, легко растворимое в воде с выделением тепла, плотностью 2,13 г/см3. Твердый гидроксид поглощает из воздуха пары воды и С02. Поставляется в твердом виде в металлических барабанах массой 200 кг или в виде 40-50 %-ного раствора. Назначение:
нейтрализация сероводорода; обеспечение растворения органических реагентов; связывание двухвалентных катионов; повышение щелочности растворов.
При разбуривании хемогенных отложений или попадании в раствор пластовой воды происходит реакция хлоридов с каустической содой, например:
СаС12 + ИаОН -> Са(ОН2) + ИаС1.
При поступлении в раствор сероводорода идет реакция
Н28 + ИаОН -> ИаНЗ + Н20.
В первом случае образуется слаборастворимый гидроксид кальция, а во втором — безвредный сульфид натрия.
Гидроксид кальция, или гашеная известь, Са(ОН)2 широко применяется для регулирования свойств глинистых растворов.
Назначение:
загущение глинистых растворов в области гидрофильной коагуляции и повышения структурных свойств растворов;
увеличение содержания катионов кальция в фильтрате;
повышение щелочности глинистых растворов.
Гашеная известь — порошок белого цвета плотностью 2,24 г/см3, слабо растворимый в воде.
Вводится в глинистый раствор в виде известкового молочка — насыщенного раствора Са(ОН)2, содержащего во взвешенном состоянии нерастворимый гидроксид кальция.
Краткая характеристика важнейших реагентов электролитов приведена в табл. 19.2.
Действие органических реагентов — защитных коллоидов на глинистые суспензии связано с тем, что при вводе их в глинистый раствор молекулы этих реагентов адсорбируются на поверхности глинистых частиц от взаимного слипания. Это приводит к повышению агрегативной устойчивости глинистой суспензии, подавлению способности глинистого раствора к структурообразованию.
Органические реагенты имеют относительно небольшую молекулярную массу, разжижают глинистые суспензии за счет значительного снижения интенсивности структурообразования.
Наиболее давно используемыми органическими реагентами являются химические реагенты на основе гуминовых кислот, сведения о которых приведены в табл. 19.3.
Высокомолекулярные органические реагенты загущают эти суспензии, чему способствует участие молекул реагента в образовании структуры при высокой концентрации указанных реагентов в растворе.
Основная особенность органических реагентов — это их способность повышать агрегативную устойчивость глинистых суспензий за счет образования на глинистых частицах защитных оболочек.
Ниже приводится характеристика наиболее часто применяемых в практике буровых работ природных или синтетических органических соединений.
Лигносульфонаты применяются для разжижения глинистых растворов, кроме того, эти реагенты понижают водоотдачу за счет дополнительного диспергирования глины и повышения концентрации коллоидной фракции твердой фазы в глинистом растворе.
|
Примерная рабочая концентрация активных веществ, промывочной жидкости или реагенте, кг/м3 |
|
Основное воздействие на необработанные глинистые растворы |
|
Содержание активных веществ в товарном продукте, % (по массе) |
|
Основное назначение и особенности применения |
|
Способ ввода в глинистый раствор |
|
Товарный вид реагента |
|
Реагент |
|
Важнейшие недостатки |
|
соленый (более 5 % солей одновалентных металлов) |
|
пресный (до 5 % солей одновалентных металлов) |
|
Каустичес ская сода (едкий натр) |
|
Сильно гидроскопическая кристаллическая масса плотностью 2,13 г/см3, поставляемая в запаянных стальных барабанах, или водный раствор различной плотности в стальных бочках |
|
Как самостоятельный реагент не применяется, но широко используется как добавка для повышения pH при использовании многих реагентов (бурый уголь, ССБ, крахмал, нитроглицерин и АР) Широко при- меняется для улучшения диспергирования глин, снижает вяз- |
|
Дороговизна, дефицитность опасность в обращении (ожоги кожи, разъедание одежды) |
|
В виде водных ратво — ров концентрацией до 10% |
|
Кальцини рованная сода (углекислый нат — рий) |
|
Белый или серый порошок плотностью 2,5 г/см3, трудно растворимый в холод- |
|
Прокаленная 98 %. Природная: 1-й сорт — 80 %; 2-й сорт — 79 % |
|
20 |
|
При малых концентрациях разжижение и некоторое снижение водо- |
|
Переводит ионы двухвалентных металлов (Са и др.) в нераство- |
|
При пониженной концентрации резко возрастают струк- турно-механи- |
|
То же или в виде порошка |
|
Гексаметафосфат натрия (ГМФН) и другие фосфаты |
|
Стекловидная масса плотностью 2,5 г/см3 |
|
кость и СНС глинистого раствора при разбурива — нии цемента, гипса или при притоках вод с содержанием кальция и т. д. Для приготовления специальных растворов, малосиликатных, повышающих устойчивость стенок скважины в глинистых породах, и д ля осаждения катионов Са, Мди др. Сравнительно редко применяется и для тех же целей, что и кальцинированная сода |
|
ческие свойства глинистых растворов |
|
отдачи, при увеличении концентрации резкое загущение и в дальнейшем коагуляция глины в растворе Повышение структурномеханических свойств и водоотдачи |
|
римое состояние, в растворах солей одновалентных металлов не эффективна |
|
В виде водных растворов |
|
То же |
|
Узкая область применения. Опасность в обращении |
|
20-50 в малосиликатных растворах |
 |
||||||
 |
||||||
|
||||||
|
||||||
|
|
|||||
 |
|
|
|
|||
|
|
|||||
|
Реагент |
Товарный вид реагента |
Содержание активных веществ в товарном продукте, % (по массе) |
Примерная рабочая концентрация активных веществ, промывочной жидкости или реагенте, кг/м3 |
Основное воздействие на необработанные глинистые растворы |
Основное назначение и особенности применения |
Важнейшие недостатки |
Способ ввода в глинистый раствор |
|
|
пресный (до 5 % солей одновалентных металлов) |
соленый (более 5 % солей одновалентных металлов) |
|||||||
|
Известь |
Негашеная — твердое вещество, гашеная — белый порошок ("пушенка"), плохо растворимый в воде |
1 100 |
3-5 в известковых растворах |
Резкое повышение структурно-механических свойств и водоотдачи |
Стабилизация путем поддержания состояния регулируемой коа — гуляции в известковых растворах |
Широко применяется для приготовления известковых глинистых растворов, а также для резкого повышения структурно-механических свойств глинистых растворов при ликвидации поглощений и для повышения pH ВКР и гипсовых растворов |
При гашении возможны ожоги |
В виде водных суспензий, известковое молоко с концентрацией извести 70- 100 кг/м3 |
|
В виде водных растворов |
|
Аналогично извести для хлоркаль- циевых растворов |
|
Хлористый кальций (хлорная известь) |
|
28-30 в водном растворе |
|
Растворением разбуренной по — роды(ан — гидрита и гипса) или в виде порошка |
|
Аналогично извести для гипсовых растворов |
|
Гипс |
|
До 100 |
|
То же |
|
Эффект действия незначите лен |
|
£ 100 |
|
Поваренная соль |
|
Гигроскопический порошок или аморфная масса в стальных барабанах, или водный раствор плотностью 1,26-1,28 г/см3 Порошок сероватого цвета, плохо раст* воримый в воде (1,7-2 %) |
|
Порошок, кристаллическая сыпучая масса |
|
3-20 при первичной обработке, 1-2 при последующих |
|
5-15 в хлор — кальциевых растворах |
|
от 0 до полного насыщения |
|
Повышение структурномеханических свойств и водоотдачи |
|
Коагуляция раствора |
|
То же |
|
Используется как источник ионов кальция при приготовлении хлор — кальциевых растворов Как самостоятельный реагент не применяется, но используется как источник ионов кальция при приготовлении гипсовых растворов Применяется в основном для насыщения промывочной жидкости перед вскрытием соленосных пород во избежание образования каверн и для |
|
1. Вследствие зависимости растворимости от температуры насыщения солью на поверхности не предохраняет полностью от растворения соли на боль- |
|
Опасность в обращении |

|
Реагент |
Товарный вид реагента |
Содержание активных веществ в товарном продукте, % (по массе) |
Примерная рабочая концентрация активных веществ, промывочной жидкости или реагенте, кг/м3 |
Основное воздействие на необработанные глинистые растворы |
Основное назначение и особенности применения |
Важнейшие недостатки |
Способ ввода в глинистый раствор |
|
|
пресный (до 5 % солей одновалентных металлов) |
соленый (более 5 % солей одновалентных металлов) |
|||||||
|
понижения температуры замерзания промывочной жидкости при бурении в мерзлых породах |
ших глубинах. 2. Концентрированные растворы рас — ■ плавляют лед и вызывают разрушение льдистых пород |
|
422 423 |
![]()
|
Таблица 19.3 Реагенты на основе гуминовых кислот
|
|
Способ ввода реагента в глинистый раствор |
То же В растворенном или сухом состоянии |
|
|
Влияние на глинистый раствор и примерная концентрация добавки на первичную обработку |
соленый [свыше 5 % ЫаС1) |
Снижает вязкость и водоотдачу (5-10%) |
|
пресный (до § % NaCl) |
Снижает вязкость и водоотдачу (1-2%) Снижает вязкость СНС более эффективно, чем УЩР |
|
|
Товарный вид реагента |
Твердое вещество То же |
|
|
Способ получения реагента. Химизм процесса |
смачивается 10- 15 %-ным раствором ЫаОН при соотношении торфа и раствора 10:2 и сушится при 150- 160 °С во избежание слеживания Нитрование бурого угля по технологии, подобной получению нитроглицерина, и нейтрализация ЫаОН. Расход ЫаОН — около 40 % от массы продукта. Придание продукту способности растворяться в воде Окисление и нитрование бурого угля НЫОз при 50-60 °С в течение 4 ч. Соотношение твердой и жидкой фаз 1:5. Затем обработка бисульфитом в присутствии щелочи (3 ч) при 92-95 °С |
|
|
Исходные компоненты для получения реагентов |
Бурый уголь, НЫОз, ЫаОН Бурый уголь, 8 %-ная кислота НЫОз, бисульфит натрия (36 %-ный ЫаОН) |
|
|
Реагент |
Нитрогуматный реагент (НГР) Сульфированный нитрогуматный реагент (CHIT) |
|
Продолжение табл. 19.3 |
Адсорбируясь на глинистых частицах, молекулы реагентов обеспечивают снижение водоотдачи, образуя при фильтрации менее проницаемую глинистую корку при затруднении отделения фильтрата.
Сульфит-спиртовая барда (ССБ) — побочный продукт производства целлюлозы из древесины, представляющий собой смесь органических веществ, в которой преобладают соли лигносульфоновых кислот: лигносульфонаты кальция, натрия, алюминия.
ССБ хорошо растворима в воде, образует коллоидный раствор. Поставляется в виде 40-50 %-ного водного раствора, реже в виде твердой вароподобной аморфной массы или порошкообразного продукта.
Основное назначение ССБ — разжижение кальциевых глинистых растворов в отличие от натриевых глинистых суспензий, где катионы кальция реагента вызывают коагуляцию таких растворов. Одновременно ССБ способствует снижению водоотдачи.
ССБ используется совместно с каустической содой (5 массовых частей ИаОН на 30 частей ССБ) для разжижения глинистых суспензий в щелочной среде.
Конденсированная сульфит-спиртовая барда (КССБ) представляет собой модификацию ССБ при нагревании ее в присутствии формалина и серной кислоты.
Разновидности КССБ:
КССБ-1 — для понижения водоотдачи пресных глинистых растворов при температуре до 120 °С, эффективно снижает вязкость кальциевых растворов;
КССБ-2 — понижает водоотдачу глинистых растворов при минерализации до 100 г/л ЫаС1 и температуре 150 °С;
КССБ-4 — для понижения водоотдачи пресных и минерализованных глинистых растворов, в пресных растворах реагент эффективен при температуре до 185-200 °С.
Окисленная сульфит-спиртовая барда (ОССБ) — это хромлигносульфонат, приготовляется путем смешивания ССБ с хромпиком (На2Сг207-2Н20) и выдерживания в течение 14-18 ч.
ОССБ способна разжижать глинистые растворы при содержании более 200 мг/л катионов кальция и высоких температурах.
Краткие сведения о лигносульфонатных реагентах приведены в табл. 19.4.
Природный водорастворимый полисахарид — крахмал, является смесью полисахаридов с общей формулой (СбНю05) п.
|
426 |
Лигносульфонатиые реагенты
|
Реагент |

|
соленый (свыше 5 % N301) |
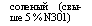
Исходные компоненты для получения реагента
Способ получения реагента. Химизм процесса
Товарный вид реагента, содержание сухого вещества
Влияние на глинистый раствор и примерная концентрация добавки на первичную обработку
пресный (до 3- 5 % №С1)
Способ ввода реагента в глинистый раствор
Сульфит-спир — товая барда (ССБ)
Конденсированная сульфит — спиртовая барда (КССБ-1)
КССБ-2
Сульфитный щелок (многотоннажный отход целлюлозно бумажной промышленности
Разбавленная ССБ (30 %-ная), 8 %-ный формалин, концентрированная Нг504
То же и 1-3 % фенола
Сбраживание сахаров, отгонка спиртов, pH =
= 5,6-5-5,7. Брутто
формула
СгвНзоО^
Конденсация при 90 — 95 °С, добавка №ОН до pH = = 8-5-9,5. Укрупнение молекул лигносульфона — тов и повышение стабилизирующих свойств То же в присутствии фенола. Образование полимерных комплексов — фенолигнин — ных производных, имеющих повышенную стойкость
Густая темнобурая жидкость с кисловатым запахом (марка КБЖ), аморфная твердая масса (КБТ) или порошок (КБП), КБЖ — 50 %, КВТ — 76 %,
КБП — 87 %. Подобна жидкой или сухой ССБ, 80 %
Снижает вязкость и водоотдачу при добавках 1-5 %
Снижает вязкость и водоотдачу (1-5 %)
То же
Снижает водоотдачу (20-50 %)
Снижает водоотдачу (10-20 %)
То же
В водном растворе
В товарном виде
То же
|
ССБ, хлор, №ОН |
|
ССБ, НИОз, №ОН |
|
То же и хрома — ты |
|
Не эффективна |
|
В товарном виде, даже при 1-0 °С |
КССБ-4
Хлорированная
сульфит-спирто-
вая барда (ХССБ)
Нитрированная сульфит-спирто — вая барда (НССБ)
То же, но хрома — тами. Усиление конденсации молекул лигносуль — фонатов, окисление, образование активных функциональных групп. Это приводит к повышению тер — мо — и солестой — кости продукта Окисление ССБ, хлорирование и нейтрализация ЫаОН до pH =
= 7-5-8. Конденсация молекул лиг — носульфонатов за счет связей, образующихся при отщеплении метоксильных групп. Усиление стабилизирующих свойств по сравнению с ССБ Нитрирование разбавленной (12 %-ной) НГТОз
при 43-48 ”С,
(87,5 % ССБ, 12,5 % НЫОз). Перемешивание 6 ч, нейтрализация ИаОН до pH = 7-5-7,3
Подобна ССБ
Подобна ССБ, 45%
Снижает вязкость (3-5 %)
Снижает вязкость и СНС (0,1-0,2 %)
Снижает вязкость и СНС (0,25-0,3 %)
|
Реагент |

|
соленый (свыше 5 % №С1) |
Исходные компоненты для получения реагента
Способ получения реагента. Химизм процесса
Товарный вид реагента, содержание сухого вещества
Влияние на глинистый раствор и примерная концентрация добавки на первичную обработку
пресный (до 3- 5 % ЫаС1)
Способ ввода реагента в глинистый раствор
Феррохромлиг-
но-сульфонат
(ФХЛС)
Хромлигносуль — фонаты ХЛС-4, окзил (окисленный замещенный сульфонат)
ССБ, 1,5-2 % Ре2(504)з 7-10 % Сг2(804) и ЫаОН
30 %-ная ССБ, 4 % К2Сг207, Н2504, ЫаОН
В раствор ССБ при 90 °С вводят реагенты стехио — метрически по отношению к Са2+ в ССБ, Рег(504)з + + Сг2(Б04)з +
+ СаЯ <=>
<=> 2ЯеСгКз +
+ 6СаБ04. Реакция окисления и замещения в щелочной среде (гипс удаляется). Образование активных функциональных групп и конденсация молекул Стабилизирующая способность и термостойкость повышаются
Реакция окисления 30 %-ной ССБ при 95 °СирН = 2 за счет добавки Н2304. Восстановление Сг6+ —> Сг3+
50%
Жидкий или порошкообразный (23-27 %)
Снижает вязкость (1-2 %)
Снижает вязкость (0,5-1 %)
Снижает вязкость (1-2,8 %) при ЫаС1 не более 5 %
Снижает вязкость (1-3 %), интенсивно сни жает водоотдачу гидрогелей магния (2-5 %)
В водном растворе
В жидком или сухом виде (полезные добавки извести или гипса)
|
То же |
![]()
|
В жидком виде |
Окисленная сульфит-спирто — вая барда (ОССБ)
30 %-ная ССБ, хроматы или бихроматы
и замещение Са2+, который образует Са504. Смесь загустевает. При нейтрализации продукта ЫаОН можно уменьшить загустевание Приготовление на буровой в глиномешалке. Окисление ССБ хромата — ми при комнатной температуре в условиях буровой (pH=8*9). Старение 8-12 ч
Жидкость, подобная ССБ, 30%
Снижает вязкость ФХЛС и ХЛС
|
429 |
Промышленность выпускает для нужд бурения модифицированный крахмал МК-1, который получают путем нагрева крахмальной суспензии до температуры 160 °С в присутствии алюмокалиевых квасцов — KA1(S04)-12H20. Реагент МК-1 представляет собой белый порошок. Постепенное распространение модифицированного крахмала происходит при циркуляции глинистого раствора. Основное назначение МК-1 заключается в понижении водоотдачи сильноминерализованных глинистых растворов, особенно в присутствии соединений кальция и магния. Сведения о МК-1 и других крахмальных реагентах приведены в табл. 19.5.
Карбоксиметилцеллюлоза (КМЦ) является водорастворимым эфиром целлюлозы, представляет собой нерастворимый в воде полисахарид [С6Н702(0Н)3]п.
КМЦ получается из целлюлозы при обработке ее NaOH и моноструктурным натрием, общая формула имеет вид:
[С6Н702(0Н)з. х — (OCH2COONa)x] n.
Разновидности КМЦ отличаются степенью замещения (СЗ), степенью полимеризации (СП), а также по виду замещений в формуле эфира целлюлозы — [С6Н702(0Н)3.х —
(OCH2COONa)x]-n — водородной формы КМЦ.
Натриевая калиевая и аммонийная соли КМЦ хорошо растворимы в воде (при СЗ > 40) и сокращенно обозначаются Na-КМЦ, К-КМЦ и ЫН4-КМЦ соответственно. Наибольшее применение получила Na-КМЦ или просто КМЦ.
Оптимальная степень замещения 80-90, при этом рост степени полимеризации до 800 способствует возрастанию стабилизирующей способности, а также термо — и солестойкости карбоксиметилцеллюлозы.
Для бурения выпускают три марки технической КМЦ: КМЦ-500, КМЦ-600 и КМЦ-700, требования к которым определяются в соответствии с ГОСТ 605-386-80 и изменением № 1 к последнему, КМЦ-500 применяют в концентрации до 2,5 % для снижения водоотдачи при насыщении раствора по NaCl и температуре до 145 °С. КМЦ-600 в концентрации до 2 % применяют для снижения водоотдачи сильноминерализованных растворов и температуре до 160 °С. КМЦ-700 в концентрации до 1,8 % применяют для снижения водоотдачи сильноминерализованных и малоглинистых растворов при температуре до 180 °С.
Влияние концентрации С реагента КМЦ-600 на свойства глинистого раствора показано на рис. 19.9. Из графиков, приведенных на рис. 19.9, видно, что КМЦ загущает пресные глинистые растворы, поскольку вызывает сильное увеличение внутреннего трения и существенный рост пластической вязкости.
|
|
|
|
![]()
|
ф х £ |
|
|
11гШ «£ зн 2 о. и о аюВ с |
 |
|
|
|

|
<& 00 •А а. 8 ж I |
|
« в® а ■а е а р 0 «2 а о | Си «в л х В в ф а ф со о. ф а г° > н о ^ и |
 |
|
|
|
|
ш* < И |
|
о с ю о и о в и |
|
ю и а. в* а в а 2 м п 5 * * Я X |
|
2* № Ф |
|
$8§* |
|
1§|а: 11Ц*$ ; щ*§ а<ф еВгш |
|
о р ~ в о.* ^«М&Йч’З.- |
 |
|
 |
|
|
|


|
Крахмальные реагенты |
|
|
||
![]()

|
|
|
9, Па-, Т, с В, см*
|
а 2 4 Б 8 Скми.,%
Рис. 19.9. Изменение свойств пресного глинистого раствора яз сарипохского бентонита под влиянием КМЦ-600
Однако минерализованные растворы при добавлении КМЦ разжижаются за счет того, что этот реагент образует на глинистых частицах защитные оболочки и подавляет структуро — образование.
Способность КМЦ понижать водоотдачу глинистых суспензий зависит от щелочности среды. Наиболее эффективно этот реагент понижает водоотдачу при pH = 8,5-ь 11.
Сведения о некоторых модификациях КМЦ и других химических реагентах — производных целлюлозы, приведены в табл. 19.6.
Поверхностно-активные вещества (ПАВ), адсорбируясь на поверхности раздела, понижают поверхностное натяжение на границе раздела фаз жидкость — газ, жидкость — твердое тело. При этом изменяются физические свойства поверхностей.
По химическому составу ПАВ разделяются на неионо- генные и ионогенные.
Неионогенные ПАВ не диссоциируют в воде на ионы, а их взаимодействие с водой обусловлено наличием гидрофильной группы в молекуле ПАВ.
Ионогенные ПАВ диссоциируют в воде на катионы и анионы. Если поверхностную активность проявляет катион,
|
Способ ввода реагента в глинистый раствор |
|
пресный (до 3-5 % ЫаС1) |
|
Товарный вид реагента, содержание сухого вещества |
|
Влияние на глинистый раствор и примерная концентрация добавки на первичную обработку |
|
соленый (свыше 5 % ЫаС1) |
 |
|
|
|
|
|
|
|
|
Влияние аналогично КМЦ, но допускает присутствие в растворе повышенной концентрации солей двух — и поливалентных металлов |

|
Сухим после дополнительного измельчения или растворенным в воде |

|
То же |
![]()
Карбоксиме- тилцеллюлоза КМЦ-500 КМЦ-600 КМЦ-700
Сульфо — эфирцеллю — лоза (СЭЦ)
Целлюлоза, монохлорук- сусная кислота или моно — хлорацетат натрия
Целлюлоза, Н2$04 или серный ангидрит, хлор — сульфоновая кислота, ЫаОН
Мерсеризация 23 %-ным раствором ЫаОН (замена ионов Н~ и Ыа+, пептизация и набухание целлюлозы), отжим, измельчение, этерфи — рикация
/ ONa
СбНтО*^- ©N8 + С1СНгООЫа -> ^ОЫа —» СбНтОгкгОЫа УЬЫа OCH2COONa + ЫаС1 созревание продукта, сушка, затаривание, придание целлюлозе способность растворяться в воде Обработка целлюлозы сульфирующим агентом в среде инертных разбавителей (алифатические спирты, керосин, бензол, толуол, хлор этан и т. п.):
/ОН
С6Н702^- ОН + НОЭОг — ОН ХЗН С6Н7О2 •«— ОН Хон
ОБОзН + Н20
Мелкозернистый или волокнистый материал, белого цвета (не менее 87 % сухого)
Внешне похожа на КМЦ
Снижает водоотдачу и повышает вязкость (0,3—
0,5 %)
Снижает водоотдачу и резко уменьшает вязкость и СНС (1-3 %) в зависимости от СП реагента)
|
В основном |
|
Растворение в 5- 10 %-ном растворе ЫаОН или других щелочных электролитов Растворение в воде |

Этансуль- фонатцеллю — лоза (ЭСЦ)
Монокар-
боксиметил-
целлюлоза
(МКЦ)
Сульфофено — локарбокси — метилцеллю — лоза (СФ — КМЦ)
Алкалицел- люлоза С6Н9040На хлорэтан — сульфокис — лый натрий ОСН2СН2 БОзЫа Целлюлоза N02 газ или N204 жидкий, или раствор N3204 в СС14, N304, ЫН40Н или N8200
КМЦ, фенол,
ЫаОН,
ЫаНБОз с последующей нейтрализацией щелочью (образуется до 45 % N32804). Замещение атома водорода сульфогруппой, придание целлюлозе способности растворяться в воде и повышение устойчивости продукта к действию солей двух — и поливалентных металлов. Путем обработки ЫаОН может быть получена Ыа-соль, известная под названием сульфат целлюлозы СЦ (СбН^ОБОзНа)
Обработка алкалицеллюлозы хлорэтансульфокислым натрием: СвНэОЫа + аСНгСНгБОз^а ->
-» СвНс^СНгЭОзНа + №С1
Окисление и нитрование целлюлозы N04, N204 и т. п., образование полиангидроуроновой кислоты, а затем ее водорастворимых солей путем обработки продукта раствором ЫаОН, ЫН4ОН или Ыа2СОз
Обработка 10 %-ного водного раствора КМЦ раствором фенолята натрия (синтетический фенол и 4 %-ный раствор ЫаОН), нагревание смеси до 70 °С, введение 40 % ного раствора ЫаНБОз и выдерживание при 85-98 °С в течение 1 ч. Совместная полимеризация фенола, КМЦ и сульфирование продукта с целью повышения термосоле — стойкосги
Рыхлая волокнистая масса или порошок желтого цвета
Похожа на КМЦ
Белая масса
Снижает водоотдачу и повышает вязкость (0,5-1 %)
Снижает водоотдачу и повышает вязкость и СНС (0,25-0,5 %)
Снижает водо отдачу (5-7 %) вязкость и СНС
Снижает водоотдачу (0,5— 1 %), вязкость и СНС, допускает повышен ную концентрацию солей двух и поливалентных металлов
то ПАВ называется катионактивным, если анион, то анионак — тивным.
К неионогенным ПАВ относятся продукты оксиэтилирова — ния жирных кислот и спиртов, амидов, фенолов, алкилфено — лов. Наиболее распространенные неионогенные ПАВ — это оксиэтилированные алкилфенолы и фенолы типа ОП-4, ОП-7, ОП-Ю и др. Молекулы этих ПАВ электрически нейтральны, что повышает устойчивость их растворов к действию минеральных солей.
К анионактивным ПАВ относятся мыла, сульфиты спиртов, ароматические сульфокислоты и др. Из них в бурении находят широкое применение сульфонаты, сульфонолы, азолят А, моющие средства: "Прогресс", "Новость" и др.
Характер действия и эффективность ПАВ зависят от их концентрации, свойств растворителя, степени минерализации подземных вод.
Поверхностно-активные вещества, понижающие поверхностное натяжение на границе раздела жидкость — воздух, относятся к группе пенообразователей и используются для получения аэрированных промывочных жидкостей и пен. Для этой цели в основном применяются анионактивные ПАВ. Их оптимальная концентрация от 0,1 до 0,5 %.
При алмазном бурении широко применяются эмульсионные жидкости, обладающие смазочными свойствами. В состав этих жидкостей входят такие ПАВ, как ОП-7, ОП-Ю, кубовые остатки жирных кислот: госсиполовая смола, кожевенная эмульгирующая паста, синтетические жирные кислоты. ПАВ широко используются для приготовления следующих эмульсо- лов: СТП-10, ленол 10, ленол 26П, морозол и др.
