ОСНОВЫ ФИЗИКО-ХИМИИ БУРОВЫХ РАСТВОРОВ
ОСНОВЫ ФИЗИКО-ХИМИИ БУРОВЫХ РАСТВОРОВ
В качестве жидкой промывочной среды при бурении скважин используют чистые жидкости (воду, керосин, беспарафин — ное дизельное топливо) и буровые растворы, являющиеся дисперсно-коллоидными системами (глинистые, стабилизированные шламовые растворы, эмульсии, растворы на нефтяной основе). Чистые жидкости и истинные растворы являются капельными, а буровые растворы, как правило,— структурными жидкостями. Истинный (химический) раствор прозрачен и при постоянстве внешних условий (температуры и давления) не выпадает в осадок. Механическая взвесь в жидкости грубодисперсного материала— суспензия — непрозрачна и с течением времени выпадает в осадок. Коллоидный раствор занимает промежуточное положение между раствором и суспензией — он не прозрачен, но не выпадает в осадок со временем.
Раствор состоит из жидкого растворителя и растворенного в нем твердого или жидкого вещества (веществ). Процесс растворения— не простое распределение одного вещества в другом, он сопровождается сложными физико-химическими взаимодействиями между молекулами и ионами этих веществ. Содержание вещества в растворе определяется его концентрацией.
Буровые промывочные жидкости могут быть одно-, двух — и многофазными физико-химическими системами. Однофазная система может состоять из двух и более веществ (например, солевой раствор сложного состава), но между компонентами системы отсутствует поверхность раздела. Такая система носит название гомогенной. Система двух — и многофазная характеризуется наличием поверхности раздела между фазами и называ
ется гетерогенной. К. гетерогенным системам относятся все дисперсные и дисперсно-коллоидные системы, т. е. большинство буровых растворов.
Наиболее важной характеристикой буровых растворов (структурных жидкостей), ответственной за их основные свойства, является дисперсность (степень измельченности) дисперсной фазы — твердого или жидкого вещества, равномерно распределенного в другом веществе — дисперсионной среде. Определяется дисперсность величиной, обратной поперечному размеру частицы:
|
(2.1) |
![]() И = Ш, см-1.
И = Ш, см-1.
С увеличением дисперсности растет общая поверхность раздела фаз, определяемая удельной поверхностью:
|
(2.2) |
![]() 50=—
50=—
V
Здесь 5 и V — соответственно поверхность и объем дисперсной фазы, к — коэффициент формы частиц. Удельная поверхность 5о также может служить мерой дисперсности, но с обязательным учетом формы частиц. Минимальную удельную поверхность имеют частицы сферической формы.
В зависимости от характерного размера частиц с1 дисперсной фазы различают следующие разновидности дисперсных систем: ^<10_7 см — истинные растворы; (1= 10_7-ь 10~5 см — коллоидные растворы; 10~5-ч-10^3 см — суспензии и эмульсии; (1> > 10_3 см — грубые взвеси.
Буровые растворы относятся к полидисперсным системам с размерами основной массы частиц твердой или жидкой дисперсной фазы в пределах 10-5—10^3 см, т. е. к суспензиям и эмульсиям. Без специальной химической обработки поверхност — но-активными веществами эти грубодисперсные системы неустойчивы. При отсутствии движения с течением времени суспензии разрушаются под влиянием седиментации — оседания, расслаивания, выпадения в осадок, эмульсии — под влиянием коа — лесценции — укрупнения жидких частиц при слиянии их между собой.
Особое место занимают глинистые растворы, являясь типичными дисперсно-коллоидными системами. Промежуточное положение коллоидного раствора между истинным раствором и суспензией объясняется чрезвычайно малыми размерами частиц дисперсной фазы, в связи с чем суммарная поверхность раздела очень велика. На этой поверхности развиваются силы физико-химического взаимодействия между фазами, превосходящие движущую силу массы твердых частиц в жидкой дисперсной среде, под ударами молекул которой коллоидные частицы находятся в хаотическом броуновском движении.
Акад. П. А. Ребиндер относит к коллоидным частицы размером менее 0,1 мкм (10-5 см), не видимые в обычные микроскопы. По классификации грунтов Н. А. Цытовича глины характеризуются частицами размером менее 5 мкм (5- 10~4 см). Ярко выраженные, вместе с тем, коллоидные свойства глинистых растворов определяются не столько размерами частиц, сколько их плоской (пластинчатой) или реже продолговатой (игольчатой) формой. Природные глины обычно представляют собой беспорядочную смесь пачек пластинчатых кристаллов, напоминающих по строению слюду. На рис. 2.5 показаны план и изометрия одной из частиц каолинита, заснятой с помощью электронного микроскопа. Благодаря такой форме частицы имеют огромную суммарную поверхность, на которой развива-
Рис. 2.5. Пластинчатая форма частицы као — ‘—
линига
ется свободная поверхностная энергия в форме адсорбционных, электрокинетических, осмотических и других сил в области раздела фаз. У самой поверхности частиц электромолекулярные силы могут достигать очень больших величин.
Различают три основные группы глинистых минералов: 1) монтмориллонит, 2) иллит (гидрослюда), 3) каолинит. Характеристика размеров элементарных глинистых частиц и их удельная поверхность в зависимости от минералогического состава приведены в табл. 2.1.
|
Таблица 2.1 Характеристика размеров и поверхности кристаллов глин
|
Глины, как правило, имеют полимерный состав.
В каждой из групп минералов существуют разновидности, отличающиеся строением и химическим составом. Наилучшими для приготовления глинистых растворов являются бентонитовые глины, состоящие в основном из монтмориллонитов. Такие глины быстро набухают и очень хорошо распускаются в воде, обеспечивая высокие качества растворов. Из глин, в которых главную роль играют каолиниты, без специальной хими
ческой обработки не удается получить высококачественные растворы. Глины иллитового типа занимают промежуточное положение.
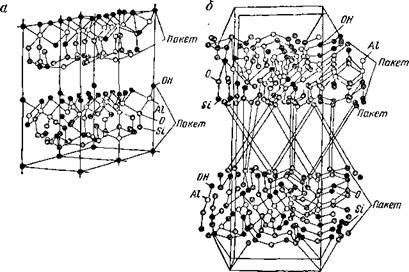
Химический состав монтмориллонитов выражают формулой АЦЛ^, Ре](513[А1, Л^Югб) (0Н)12пН20. Элементы, указанные в квадратных скобках, могут в большей или меньшей степени замещать собой соответственно А1 или 51, чем определяется наличие разновидностей минералов этой группы. Строение кри-
|
Рис. 2.6. Строение кристаллических решеток: а — каолинит; б — монтмориллонит |
сталлических решеток монтмориллонита и каолинита, различно (рис. 2.6). В отличие от каолинита с кристаллической решеткой из пяти слоев атомов, пакеты которых прочно связаны между собой, монтмориллонит характеризуется семыо слоями атомов и ослабленной связью между их пакетами. Каждый пакет, представляющий собой крепко связанные силами химического сродства плоские слои атомов А1, 51, О и группы ОН, составляет элементарный кристалл-листочек. В природных глинах на свободной поверхности кристаллов, имеющих отрицательный электрический заряд, или между соседними кристаллами в их агрегатах находятся положительные ионы (катионы) водорода Н+ и большей частью замещающих его металлов Са++, М{*++, реже №+, К+ и др. Эти катионы связывают между собой отдельные кристаллы в плоскопараллельные пачки. Чем выше заряд (валентность) катиоиа и меньше его размер, тем прочнее связь между кристаллами, тем меньше набухает и хуже распускается глина в воде. Исключение представляет ион калия К1, нмею-
|
щий малый заряд и большой радиус, но крепко связывающий кристаллы. Как видно из вывода
|
|
наибольший размер при минимальном заряде (если исключить водород, замещаемый металлами, и калий) имеет ион натрия. Поэтому натриевые глины являются наилучшими для приготовления глинистых растворов. Поверхностная активность глинистых частиц проявляется в полной мере при их соприкосновении с водой. Молекулы воды являются полярными, равные между собой положительный и отрицательный заряды распределены неравномерно. Молекулы — диполи жидкой воды находятся в непрерывном хаотическом тепловом движении, и только при ее замерзании и превращении в лед устанавливаются в строгом порядке — положительные концы одних диполей притягиваются к отрицательным концам других. При замачивании глины водой молекулы последней окружают поверхность кристаллов-листочков, проникают между кристаллами в пачках и раздвигают их. При этом глина набухает, существенно увеличиваясь в объеме. Диполи воды своими отрицательно заряженными концами притягиваются к положительным ионам металлов или водорода. Чем меньше заряд и больше размер положительно заряженных ионов, тем быстрее и легче они отрываются диполями воды от поверхности элементарных кристаллов, в результате чего нарушается связь между листочками в пачках, и глина «распускается» в воде. Отделившиеся ионы замещаются молекулами ‘воды, которые притягиваются к отрицательно заряженной поверхности кристалла своими положительно заряженными концами, пристраиваясь рядами друг к другу. |
|
Щ11 /о/’Ж ^ ‘ / ‘ 1 4 Осмотическая Обязанной СвоШш |
|
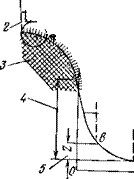
Рис. 2 7. Схема молекулярного взаимодействия сил в системе твердая частица — вода: а — ориентация диполей воды поверхностью твердой частицы; б — схема связанности воды в литосфере; в — эпюра изменений величины молекулярных сил в зависимости от расстояния до поверхности минеральной частицы; /—диффузионная оболочка; 2 — слон связанной воды; 3 — минеральная ча стица; 4 — термодинамический потенциал; 5— электрокннетичсскнй потенциал |

![]()
Электромолекулярные силы действуют на весьма небольших расстояниях, и величина их быстро уменьшается от максимума на поверхности частицы до нулевого значения при удалении на расстояние до 0,1 мкм. Несколько первых десятков рядов ориентированных молекул воды очень прочно связаны с поверхностью частицы и не отделяются даже при центрифугировании, создающем усилия, в тысячи раз превышающие силу тяжести (рис. 2.7). Этот слой связанной, или адсорбированной, воды по своей структуре напоминает лед, но не вполне аналогичен ему по свойствам. Молекулы связанной воды, составляющие так называемую граничную фазу, оказывают притягивающее и ориентирующее влияние на окружающие молекулы и ионы, что выражается в образовании диффузной оболочки. В пределах последней находятся отщепленные от поверхности частицы и окруженные диполями воды катионы, образующие «ионные облака». В отличие от адсорбированной воды граничной фазы воду в пределах диффузной оболочки называют лиосорбиро — ванной.
Электрический заряд поверхности кристалла глины частично погашается слоем связанной, или адсорбированной, воды, другая часть этого заряда погашается в диффузном слое. Отрицательно заряженная поверхность кристалла и катионы в диффузной оболочке совместно образуют двойной электрический слой. Падение напряжения на всем интервале между твердой поверхностью кристалла и свободной жидкостью называется термодинамическим потенциалом, а на участке диффузной оболочки — электрокинетическим потенциалом, или г-потенциалом.
Поверхностные слои элементарных кристаллов различных глин могут быть представлены гидроксильными группами ОН-, связь между О и Н в которых сильно полярна. В результате диссоциации молекул ионы Н+ могут отщепляться, и в этом случае глина ведет себя как кислота. Глины, в которых ионы Н+ замещены катионами металлов, можно рассматривать как соли соответствующих сложных кислот. В других условиях от поверхности частиц могут отщепляться целиком группы ОН-, замещаемые в этом случае только анионами. Природные алюмосиликаты— глины являются амфотерными адсорбентами. Это означает, что в щелочной среде от них отщепляются водородные ионы Н+, а в кислой — гидроксильные группы ОН — и соответственно на поверхности частиц могут адсорбироваться как катионы, так и анионы. Изменяя кислотность среды, можно влиять на обменные реакции между дисперсными частицами и дисперсионной средой, добиваясь адсорбции на поверхности частиц катионов или анионов.
Интенсивность электромолекулярного взаимодействия фаз в коллоидном растворе характеризуется величиной термодинамического потенциала, которая зависит от общего числа адсорбированных частицей ионов. На толщину двойного электрического слоя влияет концентрация ионов электролита в жидкости. С ее уменьшением толщина двойного электрического слоя увеличивается, поскольку часть ионов адсорбированного слоя переходит в диффузный, величина г-потенциала возрастает, и коллоидные свойства системы улучшаются.
Адсорбированный и диффузный слои образуют вокруг глинистой частицы гидратную оболочку, которая препятствует слипанию частиц между собой. Однако гидратная оболочка развита неравномерно. Наибольшая толщина ее—по плоским поверхностям частицы, наименьшая — на острых гранях и углах. В этих местах силы отталкивания ослаблены, и частицы могут слипаться между собой. Процесс слипания частиц в коллоидном растворе называется коагуляцией. Различают гидрофобную и гидрофильную коагуляции. Гидрофобная коагуляция с образованием выпадающих из раствора хлопьев происходит в условиях, когда коллоидные частицы лишены защитных гидратных оболочек и могут необратимо слипаться в любых положениях. Гидрофильная коагуляция возникает, когда коллоидные частицы неравномерно защищены гидратными оболочками и могут слипаться между собой в отдельных активных центрах коагуляции, образуя пространственную решетку (сетку, каркас), заполняющую весь объем. При этом свободная вода заключена в отдельных ячейках, как в сотах. Раствор теряет подвижность, застудневает, превращается в связно-дисперсную систему —гель. Такая коагуляция обратима. Механическое перемешивание нарушает связи между частицами, раствор вновь приобретает текучесть, превращаясь в свободно-дисперсную систему —- золь. Явление обратимого изотермического образования и разрушения пространственной структуры называется структурообразова — нием, или тиксотропией.
Свойства глинистых растворов во многом определяются сложными реакциями ионного обмена, на протекание которых могут оказывать влияние даже ничтожные количества химических реагентов. Это дает возможность повышения качества глинистых растворов из местных глин и регулирования их свойств в желаемом направлении.
Определяющим в поведении двух — и многофазных дисперсных систем, в особенности, коллоидных систем, является интенсивность электромолекул яр но го взаимодействия на границе раздела фаз, выражающаяся в физико-химическом сродстве между твердой и жидкой фазами, в смачиваемости. По степени смачиваемости эти системы делятся на лиофильные и лиофобные (гидрофильные и гидрофобные, если дисперсионной средой является вода).
Замечательные свойства глинистых растворов, выражающиеся, в первую очередь, в их стабильности, объясняются высо — коинтенсивным электромолекулярным взаимодействием между частицами глины и водой, высокой смачиваемостью, сильной природной гидрофильностыо этой дисперсно-коллоидной системы.
Большинство шламовых (естественных) растворов, кроме солевых (химических) и глинистых (коллоидных), характеризуются слабым электромолекулярпым взаимодействием между дисперсной фазой и дисперсионной средой, низкой смачиваемостью и даже гидрофобностыо. Однако с помощью обработки химическими реагентами даже грубодисперсной гидрофобной суспензии можно придать определенные коллоидные свойства. В этих целях используются реагенты-электролиты, реагенты — защитные коллоиды и поверхностно-активные вещества.
Механизм действия электролитов, распадающихся в растворе на положительно и отрицательно заряженные ионы, заключается, во-первых, в химическом изменении кислотности (или щелочности) дисперсионной среды, в замене одних ионов на поверхности частицы другими, способствующими образованию слоя связанной (адсорбированной) воды 11, во-вторых, в изменении ионного давления в диффузном слое, влияющего на степень развитости двойного электрического слоя вокруг частичек дисперсной фазы, на толщииу гидратной оболочки и коллоидные свойства системы.
Наличие электрического заряда у частиц дисперсно-коллоидной системы под воздействием разности потенциалов вызывает перемещение отрицательно заряженных частиц к положительному полюсу (и наоборот)—явление электрофореза, а если между полюсами имеется проницаемая для дисперсионной среды и непроницаемая для частиц перегородка, частицы скапливаются и оказывают давление на одну из сторон этой перегородки — явление электроосмоса. Оба эти явления важны для обеспечения закрепляющего действия буровых растворов на неустойчивые породы, слагающие стенки скважины.
Стабилизирующее действие реагентов — защитных коллоидов и ПАВ на неколлоидные шламовые растворы основано на явлениях адсорбции, которые связаны с наличием избыточной энергии на поверхности раздела фаз.
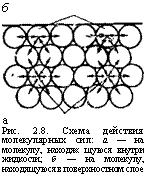
Внутри любого сплошного тела, например жидкости, силы взаимодействия между молекулами уравновешены. На поверхности раздела молекулярные силы притяжения не уравновешены (рис. 2.8). Молекулы, расположенные непосредственно на поверхности жидкости, за счет избытка сил притяжения со стороны последней сжимают ограничиваемый ими объем жидкости, что выражается в поверхностном натяжении, в стремлении поверхности раздела к уменьшению. Поверхностное натяжение в о выражают как работу образования 1 см2 поверхности или как силу, отнесенную к единице длины контура, ограничивающего поверхность жидкости, и действующую в плоскости, касательной к этой поверхности в сторону ее сокращения. Измеряется а в Дж/см2 или Н/м.
За счет некомпенсированной поверхностной энергии на границе раздела жидкой и твердой (или газообразной) фаз происходит адсорбция, т. е. возникает повышенная в сравнении с раствором концентрация какого-либо растворенного в жидкости вещества (адсорбтива). В силу диффузии молекулы адсорбтива равномерно распределяются в объеме раствора, но, встречаясь с поверхностью твердой фазы (адсорбента), обладающей большими силами притяжения, накапливаются на ней. Адсорбция непрерывно сопровождается десорбцией — отрывом от поверхности адсорбента и уходом в раствор части молекул адсорбтива. Момент насыщения поверхности раздела молекулами адсорбтива наступает в условиях динамического равновесия между адсорбцией и десорбцией.
|
б а Рис. 2.8. Схема действия молекулярных сил: а — на молекулу, находя« щуюся внутри жидкости; б — на молекулу, находящуюся в поверхностном слое |
|
поверхности раздела |
 Молекулы защитных коллоидов и ПАВ, эффективных для обработки буровых растворов, имеют дифильное строение, т. е. включают гидрофобную и Способную гидратироваться — гидрофильную группы. Адсорбируясь на границе раздела фаз, эти молекулы ориентируются таким образом,, что имеющая. сродство с водой гидрофильная группа обращена к воде, а гидрофобная группа — к твердой фазе в растворе (к маслу в эмульсии, к воздуху в цепе). При обычно применяемой в практике концентрации эти молекулы образуют на плотно упакованный слой. Их концентрация в адсорбционном слое толщиной 10-7-М0~8 см может в десятки тысяч раз превышать концентрацию в растворе.
Молекулы защитных коллоидов и ПАВ, эффективных для обработки буровых растворов, имеют дифильное строение, т. е. включают гидрофобную и Способную гидратироваться — гидрофильную группы. Адсорбируясь на границе раздела фаз, эти молекулы ориентируются таким образом,, что имеющая. сродство с водой гидрофильная группа обращена к воде, а гидрофобная группа — к твердой фазе в растворе (к маслу в эмульсии, к воздуху в цепе). При обычно применяемой в практике концентрации эти молекулы образуют на плотно упакованный слой. Их концентрация в адсорбционном слое толщиной 10-7-М0~8 см может в десятки тысяч раз превышать концентрацию в растворе.
Адсорбция измеряется количеством адсорбтива в молях или граммах на едииице поверхности или массы адсорбента. Адсорбция сопровождается изменением поверхностного натяжения. Поверхностно-активные вещества (ПАВ) имеют положительную адсорбцию, т. е. накапливаются на границе раздела фаз и при этом снижают поверхностное натяжение. Существуют поверхностно-активные вещества, обладающие отрицательной адсорбцией. Сознательно введенные в буровой раствор или поступающие в него в процессе бурения растворимые вещества могут оказывать различное влияние на поверхностное натяжение, на степень и направление электро-молекулярных взаимодействий на границе раздела фаз. С повышением температуры поверхностное натяжение снижается.
Высокомолекулярные гидрофильные (защитные) коллоиды и ПАВ, адсорбируясь на границе раздела поверхности частиц гидрофобной дисперсной фазы шламовых растворов и воды, изменяют свойства поверхности, придают ей высокое сродство
с водой, смачиваемость (гидрофильность). В результате образуются мицеллы стабилизированного гидрофобного коллоида. Мицелла состоит из элементарной частицы гидрофобной фазы, адсорбированного на ней слоя защитного коллоида или ПАВ и гидратной оболочки, представленной слоями ориентированных молекул воды и диффузным слоем. Гидратные оболочки частиц стабилизируют буровой шламовый раствор, устраняя слипание частиц и выпадение их агрегатов из раствора в осадок.
Достигаемую с помощью стабилизации устойчивость бурового раствора подразделяют на седиментационную и агрега* тивную. Седиментациониая (или кинетическая) устойчивость является результатом совместного проявления противоположных процессов — оседания под действием движущей силы веса дисперсиых частиц в дисперсионной среде и хаотического теплового (броуновского) движения, распределяющего частицы равномерно по объему раствора. Седиментациониая устойчивость возрастает с увеличением дисперсности и температуры. Агрега — тивная устойчивость, выражающаяся в способности мицелл не слипаться между собой в любых положениях, т. е. в способности дисперсных частиц не объединяться в выпадающие из раствора агрегаты, также есть результат совместного проявления противоположных процессов — слипания хаотически движущихся частиц под действием ваандерваальсовых сил межмо — лекулярного притяжения и отталкивания мицелл друг от друга за счет электрических сил отталкивания между ионами одного заряда в диффузной оболочке мицелл. Агрегативная устойчивость тем выше, чем более развиты гидратные оболочки частиц, т. е. чем дисперснее твердая фаза и сильнее смачиваемость ее поверхности.
Различают свободно-дисперсные (бесструктурные) системы, не оказывающие сопротивления сдвигу, и связно-дисперсные (структурированные) системы, обладающие всеми признаками коллоидного раствора, прежде всего, тиксотропией, способностью обратимого перехода из золя в гель и наоборот. Та и другая системы могут иметь одну природу, но отличаться концентрацией дисперсной фазы, которая для образования пространственной структуры должна быть достаточно большой.
Особую пространственную структуру представляет собой пена. В основе получения пены заложено резкое снижение поверхностного натяжения воды на границе раздела с воздухом (газом, паром) за счет адсорбции ПАВ. Поверхностное натяжение водных растворов ПАВ обычно имеет значения в пределах а=28—36Х10-3 Н/м. Дисперсионной средой пены считается вода, а дисперсной фазой — воздух. Структура пены определяется объемным соотношением жидкой и газовой фаз. Когда объем воздуха в десятки и сотни раз превышает объем воды, ячейки пены представляют собой многогранники, разделенные очень тонкими пленками, которые состоят из двух слоев
адсорбированных молекул ПАВ и прослойки воды (раствора) между ними. В местах стыков пленок образуются утолщения, называемые каналами. Совокупность пленок и каналов, пронизывающая весь объем пены, образует пространственный каркас, обладающий определенной прочностью и определяющий собой свойства пены.
Адсорбция ПАВ на поверхностях раздела фаз играет весьма важную роль не только в процессах очистки забоя и транспортирования шлама при бурении скважин, ио и лежит в основе явления понижения прочности горных пород.