 Вода при 4 градусах Цельсия
Вода при 4 градусах Цельсия
Вода при 4°С
Вопрос:
При 4 °С вода имеет наивысшую плотность. Почему? почему вода на деньке водоема конкретно при этой температуре? заблаговременно спс. Саша
Ответ:
Почетаемый, Александр!
Вода — одно из самых таинственных веществ нашей планетки. Будучи обычным мономолекулярным соединением, она должна была бы кипеть при + 70°C, а леденеть практически при -100°C. В отличие от всех других жидкостей, вода при затвердевании уменьшает собственный вес. Наибольшая плотность воды наблюдается при +4°C. Данный факт очень важен для биосферы. В итоге лед появляется на поверхности водоемов, не давая им вымерзать до дна, и, тем, не давая погибнуть рыбам и иным представителям аква фауны в зимнее время.
Поверхностное натяжение незапятанной воды больше, чем у хоть какой другой воды, не считая ртути. У полностью незапятанной воды поверхностное натяжение таково, что по ней можно было бы кататься на коньках. Наличие примесей резко понижает величину поверхностного натяжения воды. Одна из «странностей» воды в том, что это вещество — единственное на Земле — всегда выступает в 3-х фазах — водянистом, жестком и газообразном.
Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в верхушке — ядро атома кислорода. Межъядерные расстояния О-Н близки к 0,1 нм, расстояние меж ядрами атомов водорода равно приблизительно 0,15 нм. Из восьми электронов, составляющих наружный электрический слой атома кислорода в молекуле воды, две электрические пары образуют ковалентные связи О-Н, а другие четыре электрона представляют собой две неподеленные электрические пары. Таким макаром, молекула воды представляет собой небольшой диполь, содержащий положительный и отрицательный заряды на полюсах. Потому что масса и заряд ядра кислорода больше чем у ядер водорода, то электрическое скопление стягивается в сторону кислородного ядра. При всем этом ядра водорода “оголяются”. Таким макаром, электрическое скопление имеет неоднородную плотность. Около ядер водорода имеется недочет электрической плотности, а на обратной стороне молекулы, около ядра кислорода, наблюдается излишек электрической плотности. Конкретно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится большая геометрическая фигура — верный тетраэдр.
Молекулярная масса парообразной воды равна 18 и отвечает ее простейшей формуле. Но молекулярная масса водянистой воды, определяемая методом исследования ее смесей в других растворителях, оказывается более, высочайшей. Это свидетельствует о том, что в водянистой воде происходит ассоциация молекул, т.е. соединение их в более сложные агрегаты. Таковой вывод подтверждается и аномально высочайшими значениями температур плавления и кипения воды. Ассоциация молекул воды вызвана образованием меж ними водородных связей.
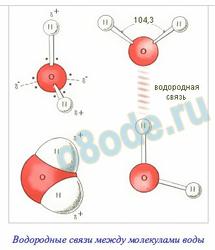 Благодаря наличию водородных связей любая молекула воды образует водородную связь с 4-мя примыкающими молекулами, образуя ажурный сетчатый каркас в молекуле льда. Но, в водянистом состоянии вода – неупорядоченная жидкость; эти водородные связи — спонтанные, короткоживущие, стремительно рвутся и образуются вновь. Всё это приводит к неоднородности в структуре воды.
Благодаря наличию водородных связей любая молекула воды образует водородную связь с 4-мя примыкающими молекулами, образуя ажурный сетчатый каркас в молекуле льда. Но, в водянистом состоянии вода – неупорядоченная жидкость; эти водородные связи — спонтанные, короткоживущие, стремительно рвутся и образуются вновь. Всё это приводит к неоднородности в структуре воды.
Водородные связи меж молекулами воды
То, что вода неоднородна по собственному составу, было установлено издавна. Издавна понятно, что лёд плавает на поверхности воды, то есть плотность кристаллического льда меньше, чем плотность воды. Практически у всех других веществ кристалл плотнее водянистой фазы. К тому же и после плавления при повышении температуры плотность воды продолжает возрастать и достигает максимума при 4°C. Наименее известна аномалия сжимаемости воды: при нагреве от точки плавления прямо до 40°C она миниатюризируется, а потом возрастает. Теплоёмкость воды тоже зависит от температуры немонотонно. Не считая того, при температуре ниже 30°C с увеличением давления от атмосферного до 0,2 ГПа вязкость воды миниатюризируется, а коэффициент самодиффузии — параметр, который определяет скорость перемещения молекул воды относительно друг дружку растёт. Для других жидкостей зависимость оборотная, и почти нигде не бывает, чтоб некий принципиальный параметр вёл себя не монотонно, т.е. поначалу рос, а после прохождения критичного значения температуры или давления уменьшался. Появилось предположение, что на самом деле вода — это не единая жидкость, а смесь 2-ух компонент, которые различаются качествами, к примеру плотностью и вязкостью, а следовательно, и структурой. Такие идеи стали появляться в конце XIX века, когда накопилось много данных об аномалиях воды.
На данный момент наукой подтверждено, что особенности физических параметров воды и бессчетные короткоживущие водородные связи меж примыкающими атомами водорода и кислорода в молекуле воды делают подходящие способности для образования особенных структур-ассоциатов (кластеров), воспринимающих, хранящих и передающих самую различную информацию.
Структурной единицей таковой воды является кластер, состоящий из клатратов, природа которых обоснована далекими кулоновскими силами. В структуре кластров закодирована информация о взаимодействиях, имевших место с данными молекулами воды. В аква кластерах за счёт взаимодействия меж ковалентными и водородными связями меж атомами кислорода и атомами водорода может происходить миграция протона (Н+) по эстафетному механизму, приводящие к делокализации протона в границах кластера.
Вода, состоящая из огромного количества кластеров разных типов, образует иерархическую пространственную жидкокристаллическую структуру, которая может принимать и хранить большие объемы инфы.
Лёд – кристаллическая модификация воды. По последним данным лёд имеет 14 структурных модификаций. Посреди их есть и кристаллические (их большая часть) и бесформенные модификации, но они все отличаются друг от друга обоюдным расположением молекул воды и качествами. Правда, все, не считая обычного нам льда, кристаллизующего в гексагональной сингонии, образуются в критериях экзотичных — при очень низких температурах и больших давлениях, когда углы водородных связей в молекуле воды меняются и образуются системы, хорошие от гексагональной. Такие условия напоминают галлактические и не встречаются на Земле. К примеру, при температуре ниже –110 °С водяные пары выпадают на железной пластинке в виде октаэдров и кубиков размером в несколько нанометров — это так именуемый кубический лед. Если температура чуток выше –110 °С, а концентрация пара очень мала, на пластинке формируется слой только плотного бесформенного льда.
Более изученным является лёд I-й природной модификации. Лёд встречается в природе в виде льда (материкового, плавающего, подземного и т.д.), также в виде снега, инея и т.д. Он распространён во всех областях обитания человека. Собираясь в множествах, снег и лед образуют особенные структуры с принципно другими, ежели у отдельных кристаллов либо снежинок, качествами. Ледники, ледяные покровы, нескончаемая мерзлота, сезонный снежный покров значительно оказывают влияние на климат огромных регионов и планетки в целом: даже те, кто никогда не лицезрел снега, ощущают на для себя дыхание его масс, скопившихся на полюсах Земли, к примеру, в виде долголетних колебаний уровня Мирового океана. Лед имеет настолько огромное значение для вида нашей планетки и комфортабельного обитания на ней живых созданий, что ученые отвели для него необыкновенную среду — криосферу, которая простирает свои владения высоко в атмосферу и глубоко в земную кору.
Две последние модификации льда — XIII и XIV — открыли ученые из Оксфорда совершенно не так давно, в 2006 году. Предположение о том, что должны существовать кристаллы льда с моноклинной и ромбической решетками, было тяжело подтвердить: вязкость воды при температуре –160°С очень высока, и собраться совместно молекулам незапятанной переохлажденной воды в таком количестве, чтоб образовался эмбрион кристалла, тяжело. Этого удалось достигнуть при помощи катализатора — соляной кислоты, которая повысила подвижность молекул воды при низких температурах. В земной природе подобные модификации льда создаваться не могут, но они могут встречаться на замерзших спутниках других планет.
Табл. Некие известные модификации льда
Примечание. 1 A=10-10 м.
Разгадка структуры льда заключается в строении его молекулы. Кристаллы всех модификаций льда построены из молекул воды H2O, соединённых водородными связями в трёхмерный каркас, аналогичный структуре алмаза. Конкретно в связи с тем, что лёд имеет такую высокорегулярную сетчатую структуру и связи с низким координационным числом лёд имеет невысокую плотность.
Рис. Структура алмаза
Рис.. Структура льда.
Любая молекула в структуре льда участвует в 4 таких связях, направленных к верхушкам тетраэдра. При содействии протона одной молекулы с парой неподеленных электронов кислорода другой молекулы появляется водородная связь, наименее мощная, чем связь внутримолекулярная, но довольно могущественная, чтоб задерживать рядом примыкающие молекулы воды. Любая молекула может сразу создавать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28′, направленных к верхушкам тетраэдра, которые не позволяют при замерзании создавать плотную структуру. При всем этом в структурах льда I, Ic, VII и VIII этот тетраэдр верный. В структурах льда II, III, V и VI тетраэдры приметно искажены. В структурах льда VI, VII и VIII можно выделить 2 взаимоперекрещивающиеся системы водородных связей. Этот невидимый каркас из водородных связей располагает молекулы в виде сетчатой сетки, по структуре напоминающей соты с полыми каналами. Если лед подогреть, сетчатая структура разрушится: молекулы воды начинают проваливаться в пустоты сетки, приводя к более плотной структуре воды, — вот поэтому вода тяжелее льда.
Лед, который появляется при атмосферном давлении и плавится при 0 °С, — самое обычное, но всё же до конца не понятное вещество. Почти все в его структуре и свойствах смотрится особенно. В узлах кристаллической решетки льда атомы кислорода выстроены упорядоченно, образуя правильные шестиугольники, а атомы водорода занимают самые различные положения повдоль связей. Потому вероятны 6 эквивалентных ориентаций молекул воды относительно их соседей. Часть из их исключается, так как нахождение сразу 2 протонов на одной водородной связи маловероятно, но остаётся достаточная неопределённость в ориентации молекул воды. Такое поведение атомов необычно, так как в жестком веществе все подчиняются одному закону: или все атомы размещены упорядоченно, тогда и это — кристалл, или случаем, тогда и это — бесформенное вещество. Такая необыкновенная структура может реализоваться в большинстве модификаций льда — I, III, V, VI и VII (и по-видимому в Ic), а в структуре льда II, VIII и IX молекулы воды ориентационно упорядочены. По выражению Дж. Бернала лёд кристалличен в отношении атомов кислорода и стеклообразен в отношении атомов водорода.
Значение льда тяжело недооценить. Лёд оказывает огромное воздействие на условия обитания и жизнедеятельности растений и животных, на различные виды хозяйственной деятельности человека. Покрывая воду сверху, лед играет в природе роль собственного рода плавучего экрана, защищающего реки и водоемы от предстоящего замерзания и сохраняющего жизнь подводному миру. Если б плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к смерти всех живых созданий в реках, озерах и океанах, которые промерзли бы полностью, превратившись в глыбы льда, а Земля стала ледяной пустыней, что безизбежно привело бы к смерти всего живого.
В связи с широким распространением воды и льда на Земле отличие параметров льда от параметров других веществ играет важную роль в природных процессах. Вследствие наименьшей, чем у воды, плотности лёд образует на поверхности воды плавучий покров, предохраняющий реки и водоёмы от донного замерзания. Зависимость меж скоростью течения и напряжением у поликристаллического льда гиперболическая; при приближённом описании её степенным уравнением показатель степени возрастает по мере роста напряжения.
Не считая того, скорость течения льда прямо пропорциональна энергии активации и назад пропорциональна абсолютной температуре, так что с снижением температуры лёд приближается по своим свойствам к полностью твёрдому телу. В среднем при близкой к таянию температуре текучесть льда в 106 раз выше, чем у горных пород. Благодаря собственной текучести лёд не накопляется в одном месте, а в виде ледников повсевременно перемещается.
К другим необыкновенным свойствам льда относят и генерацию электрического излучения его возрастающими кристаллами. Понятно, что большая часть растворенных в воде примесей не передается льду, когда он начинает расти; они вымораживается. Потому даже на самой грязной луже пленка льда незапятнанная и прозрачная. При всем этом примеси накапливаются на границе жесткой и водянистой сред, в виде 2-ух слоев электронных зарядов различного знака, которые вызывают значительную разность потенциалов.
Заряженный слой примесей перемещается совместно с нижней границей юного льда и испускает электрические волны. Благодаря этому процесс кристаллизации можно следить в деталях. Так, кристалл, возрастающий в длину в виде иголки, испускает по другому, чем покрывающийся боковыми отростками, а излучение возрастающих зернышек отличается от того, что появляется, когда кристаллы лопаются. По форме, последовательности, частоте и амплитуде импульсов излучения можно найти, с какой скоростью леденеет лед и какая при всем этом выходит ледовая структура.
Так почему же наибольшая плотность воды наблюдается при +4°C? Дело в том, что при таянии льда его структура разрушается. Да и в водянистой воде сохраняются водородные связи меж молекулами: образуются ассоциаты — осколки структур льда, — состоящих из большего либо наименьшего числа молекул воды.
Но в отличит от льда каждый ассоциат существует очень куцее время: повсевременно происходит разрушение одних и образование других агрегатов. В пустотах таких “ледяных” агрегатов могут располагаться одиночные молекулы воды; при всем этом упаковка молекул воды становится более плотной. Вот поэтому при таянии льда объем, занимаемый водой, миниатюризируется, а ее плотность растет.
Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются вместе своими разноименными полюсами. Молекулы образуют слои, при этом любая из их связана с 3-мя молекулами, принадлежащими к тому же слою, и с одной – из примыкающего слоя. Структура льда принадлежит к менее плотным структурам, в ней есть пустоты, размеры менее плотным структурам, в ней есть пустоты, размеры которых несколько превосходят размеры молекулы.
Вода при таянии льда сохраняет температуру 4 °С, пока не растает весь лёд. При всем этом специфичность межмолекулярных взаимодействий, соответствующая для структуры льда, сохраняется и в талой воде при 4 0С, потому что при плавлении кристалла льда разрушается только 15% всех водородных связей в молекуле. Потому присущая льду связь каждой молекулы воды с 4-мя примыкающими молекулами в значимой степени не нарушается, хотя и наблюдается бoльшая размытость кислородной каркасной решетки.
Потому вода при 4 0С отличается от обыкновенной обилием многомолекулярных кластеров, в каких в течение некого времени сохраняются рыхловатые льдоподобные структуры. После таяния всего льда температура воды увеличивается и водородные связи снутри кластеров перестают противостоять растущим термическим колебаниям атомов. Размеры кластеров меняются, и потому начинают изменяться характеристики талой воды: диэлектрическая проницаемость приходит к собственному сбалансированному состоянию через 15-20 минут, вязкость — через 3-6 суток. Био активность таковой талой воды спадает, по одним данным, примерно за 12-16 часов, по другим — за день. Физико-химические характеристики талой воды самопроизвольно изменяются во времени, приближаясь к свойствам обыкновенной воды: она равномерно вроде бы «запамятывает» о том, что еще не так давно была льдом.
Но по мере нагревания воды, обломков структуры льда в ней становится меньше, что приводит к предстоящему увеличению плотности воды. В интервале температур от 0 до 4°С этот эффект преобладает над термическим расширением, так что плотность воды продолжает возрастать. Но при нагревании выше 4°С преобладает воздействие усиления термического движения молекул и плотность воды опять миниатюризируется. Потому при 4°С вода обладает наибольшей плотностью. При нагревании воды часть теплоты затрачивается на разрыв водородных связей (энергия разрыва водородной связи в воде составляет приблизительно 25 кДж/моль). Этим фактом и разъясняется а именно, высочайшая теплоемкость воды.
Таким макаром, повышение плотности при плавлении, как и в случае плотных модификаций льда, разъясняется искривлением водородных связей и отклонением углов меж ними от тетраэдрических. Искривление связей возрастает с ростом температуры и давления, что приводит к возрастанию плотности. С другой стороны, при нагревании средняя длина водородных связей становится больше, в итоге чего плотность миниатюризируется. Совместное действие 2-ух причин разъясняет наличие максимума плотности воды при 4 °С.
Плотность воды является одним из её важных параметров. Наивысшую плотность пресная вода имеет при 4 С. При этой температуре один килограмм воды занимает малый объем. При снижении температуры от 4 0С до 0 С плотность воды миниатюризируется, т. е. вода с температурой 4 0С находится понизу как более уплотненная вода, а более прохладная вола с низкой плотностью подымается наверх, где и леденеет, превращаясь в лед. Понятно, почему не работает механизм конвекции: плотность нагреваемой сверху воды миниатюризируется, она не может опуститься вниз и дать тепло льду. Плотность льда в свою очередь меньше плотности воды, потому лед плавает на поверхности, предохраняя воду от предстоящего остывания.
Если б ни аномалия плотности воды, т.е. при снижении температуры и при переходе из водянистого состояния в жесткое плотность воды изменялась так же, как это происходит у подавляющего большинства веществ, то при приближении зимы поверхностные слои природных вод охлаждались. бы до 0°С и опускались на дно, освобождая место более теплым слоям, и так длилось бы до того времени, пока вся масса водоема не заполучила бы температуру 0°С. Дальше вода начинала бы леденеть, образующиеся льдины погружались бы на дно и водоем промерзал бы на всю его глубину. При всем этом формы жизни в воде могли быть невозможны. Но потому что большей плотности вода добивается конкретно при 4 °С, то перемещение ее слоев, вызываемое остыванием, завершается при достижении этой температуры. При предстоящем снижении температуры охлажденный слой, владеющий наименьшей плотностью, остается на поверхности, леденеет и тем защищает лежащие ниже слои от предстоящего остывания и замерзания.
В отличие от пресной воды, морская вода при охлаждении ведет себя по другому. Леденеет она не при 0 0С, а при -1,8-2,1 0С — зависимо от концентрации растворенных в ней солей. Имеет наивысшую плотность не при + 4 0С, а при -3,5 0С. Таким макаром, она преобразуется в лед, не достигая большей плотности. Если вертикальное смешивание в пресных водоемах прекращается при охлаждении всей массы воды до +4 0С, то в морской воде происходит даже при температуре ниже 0 0С. При всем этом процесс обмена меж верхними и нижними слоями идет безпрерывно.
С почтением,
к.х.н. О.В. Мосин