КАЧЕСТВА И СВОЙСТВА ПРИРОДНОЙ ВОДЫ
КАЧЕСТВА И СВОЙСТВА ПРИРОДНОЙ ВОДЫ
В естественных условиях вода не встречается в химически чистом состоянии. В процессе круговорота в природе вода, соприкасаясь с воздухом, воч — вой, осадочными и изверженными породами, насыщается различными примесями, растворимыми и нерастворимыми веществами. Одновременно в ней могут появляться растительные и животные организмы, а также продукты их разложения.
Состав и концентрация примесей в воде (поверхностной и подземной) в различных точках земной поверхности разнообразны. Можно считать, что волы> текущие по поверхности, в большинстве мало минерализованы, не содержат взвешенные минеральные и органические примеси.
Поверхностные воды содержат 80 % карбонатов, 13 % сульфатов и 7 % хлоридов, а морские воды — 89 % хлоридов, 10 % сульфатов и 0,2 % карбонатов.
Подземные воды отличаются от поверхностных более высокой минерализацией, отсутствием взвешенных веществ (минеральных и органических), наличием (во многих случаях) газов, постоянной температурой (в пределах 5- 12 °С).
Основной причиной обогащения речной воды растворенными неорганическими примесями являются грунтовое питание рек подземными источниками. Грунтовое питание носит гораздо более устойчивый характер, чем поверхностный сток.
Вода имеет некоторое качество и обладает определенными свойствами. Под качеством воды понимается совокупность физических, химическим и бактериологических показателей, обуславливающих ее свойство и пригодность для использования в промышленном производстве, быту и т. п. Под свойством воды следует понимать отличительную особенность, проявляющуюся при определенном качестве ее и условиях, например, солевые отложения, вызывать коррозию металла и т. п.
Плотность чистой воды при 35 °С и атмосферном давлении — 999 кг/м3. С увеличением концентрации примесей плотность воды возрастает. Морская вода с концентрацией солсй 35 кг/мэ имеет среднюю плотность 1028 кг/м3 при 0 °С. Изменение еолесодержания иа 1 кг/м3 изменяет плотность на 0,8 кг/м3.
Вязкость р воды с повышением температуры і уменьшается следующим образом:
/,° С…………… 0 5 10 15 20 25 30 35
ц-10“3, Па-с. 1,797 1,523 1,301 1,138 1,007 0,895 0,800 0,723
С увеличением еолесодержания вязкость воды повышается. Поверхностное натяжение Q воды при 18 °С составляет 73, при 100 °С — 52,5 мН/м. Теплоемкость воды при 0 °С составляет 4180 дж/(кг-°С), а при 35 °С достигает минимума. Теплота плавления при переходе льда в жидкое состояние составляет 330 кДж/кг, теплота парообразования равна 2250 кДж/кг при атмосферном давлении и температуре 100 °С.
Вода — слабый проводник электрического тока: удельная электрическая проводимость при 18 °С равна 4,91 ] 01 См/м (4,41 10"8 1/Ом-см); диэлектрическая постоянная равна 80.
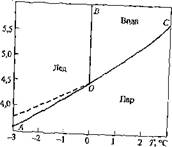
На рис. 3.1 приведена диаграмма состояний воды.
При наличии лишь одной фазы (лсд вода или пар) S = 2, так что можно произвольно менять как температуру, так и давление. Например, можно иметь пар при любой температуре и под любым давлением, если, только не перейдена та граница, при которой наступает конденсация. На рис.3.1, область пара соответствует ограниченному участку плоскости, в пределах которого состоя-
|
|
Рнс. 3.1. Диаграмма состояний волы
"р№ЗВОЛЬНо1_МИшъ- Такая система с двумя степенями свободы ИВЯРИШШ10И — Ж М0ЖН° повторить относительно ВОДЫ и льда> іу из которых соответствует на диаграмме свой участок плоскости.
СИСТемы До“ло Д° границы раздела между участками, то НЯПІТРИМ і — ? ®~ТОр0Й 4)азЬ1, Например, при охлаждении пара псщ е а1’до начинается его конденсация, а при нагревании ль^ д д влением ат до О С~- плавление. Появление второй фазы уменьшаем число степеней свободы до ед швдда (5= 3 -/= з — 2). Теперь уже давление температура не могут бьто одновременно произвольно выбраны. Если две фаз^ находятся друг е другом в равновесии, то каждой температуре соответствуем свое давление, и наоборот. Состояния существования двух фаз обозначены «а рис.6 сплошными линиями; соответствующие им системы с одной степень^ свободы называются модавариантными. Кривая ОС называется геривой давле. ния насыщенного пара над жидкой водой, ВО ■— кривой плавления и АО кривой возгонки (сублимации) или кривой давления насыщенного пара льдом.
Все три кривые сходятся в точке О, іде три фазы сосуществуют в равное^ сии друг с другом. Появление третьей фазы уменьшает число степеней своб0ч ды до нуля ( у 3 — 3) т. е. трехфазная система может существовать лиіц^
при одной определенной совокупности температуры и давления (для BOflbj. +0,007600 °С и 0,457 мм. рт. ст.). Такая система называется нонвариантаой, ^ точка О—тройной точкой. Правило фаз доказывает, что в однокомпонентно^ системе три кривые сходятся именно в одной точке, но не могут пересекатьс^ так как в точке пересечения существовало бы четыре фазы, что, как уже гов^’ рилось выше невозможно.
Вода может существовать также в перегретом и переохлажденном состояниях; в последнем состояния может существовать и пар. Этим термодинамическим неравновесным метастабильным (лабильным) состояниям, нарушаемым случайными внешними причинами, например, размешиванием соответствуют свои линии раздела фаз (нарис. 3.1. — пунктир). К ним правило фаз неприменимо, гак как оно относится лишь к равновесию.
Диаграмма состояния воды усложняется при переходе к высоким давлениям.
Для практических целей промышленного водоснабжения достаточным является лабораторный контроль за физическими, химическими и бактериологическими показателями воды.
Вода содержит целый ряд разнообразных примесей как органического, так и неорганического состава.
Если все примеси, загрязняющие воду, сформировать в іруппьі по их физико-химическому состоянию и размеру (по дисперсности), то можно выделить четыре группы (табл.3.1).
В первую подгруппу входят взвеси довольно крупных частиц. В состав крупных взвесей входят частицы плохо растворимых глин, песок, планктон, карбонатные породы, нерастворимые гидроокиси металлов и др. Такие взвеси неустойчивы и легко расслаиваются.
В состав второй подгруппы (тонкие взвеси) — суспензии (например, суспензии глины в воде), эмульсии (нефть в воде), пены, а также бактерии (в том числе болезнетворные). Эти суспензии более устойчивы и трудноразделимы по сравнению с первой подгруппой.
В состав второй группы входят коллоидные и высокомолекулярные соединения (ВМС). К ним относятся: минеральные частицы гумусовых веществ,
|
Таблица 3.1 КЛАССИФИКАЦИЯ ПРИМЕСЕЙ ПРИРОДНЫХ ВОД
|
которые придают воде окраску. К этой же группе могут ЙЫе Микроорганизмы, в том числе вирусы.
|
быть отнесены разят- газы и органические соеда- „.„.„г, гУМИНОВЫе и вуль |
Тркгыо группу входят растворенные в воде газы и органические v~ ‘ ■ >тт’ как биологического происхождения, например, гуминовые и вульво — кивдоты, так и промышленного происхождения (фенолы и др.)- Эти вещества тоте®01- привкус и запахи, иногда окраску. Некоторые из них могут быть
1®’ппа объединяет вещества, диссоциирующие в воде на ионы. К пые Относятся С0ЛИ (Б ТОМ числе сопи жесткости), основания и кислоты, которые присутствуют во всех водах.
ми зта^1ВЛЯеТ ИНТеРес 0РОследаь, какими обрагноосмотичесішми метода — СодєожаттЄЛН Могут ®ьпъ здаммы из водных растворов (рис. 3.2). извещенных жщееп’т! Х жщесш — Мутность. Количественное содержание совым способом КиВкВЗД! Может6ытьопределено или непосредственнове — ноии)воды. " осве1шо путем определения мутности (или прозрач-
ческих примесей, находящтс01^ Наличием в Ней различного рода механики, илистых частиц органиче™пгВЗВЄШЄННОМ соаояНии’ частиц песка, гли — свойственна воде ПОВерхНОСТНыу ™ происх02КДевия и др. Мутность обычно рактера грунта диа и берегов рек ”°ЧНИков и главным образом рек. От ха — вымывания частиц грунта, увлекаеми™**10™ течения В°ДЫ зависит степень
тем больших размеров частицы могут увлекаться водой. При определенной скорости течения воды частицы поддерживаются во взвешенном состоянии и придают воде мутность. Мутность воды определяют специальными приборами — мутномерами. В настоящее время для определения мутности стали применять приборы, основанные на действии фотоэлементов — нефелометры.
Прозрачность воды измеряют в стеклянном цилиндре или стеклянной трубке е сантиметровой шкалой. При этом определяют толщину слоя воды (в см), через который еще виден нанесенный черной краской на белой пластинке условный знак в виде двух крестообразно расположенных линий толщиной 1 мм (крест) или специальный стандартный шрифт. Таким образом, прозрачность измеряется в см вод. ст.
Содеркание взвешенных веществ в речной воде (а, следовательно, ее мутность и прозрачность) меняется в течение года, возрастая в период дождей и доходя до максимума в период паводков: Наименьшая мутность (наибольшая прозрачность) речной воды наблюдается обычно в зимнее время, когда река покрыта льдом. В озерах и искусственных водохранилищах мутность, как правило, незначительна и обусловливается поступлением мутной воды из рек, питающих данные водоемы, а также поверхностных стоков с их берегов. В больших водоемах замутнение воды происходит в результате взмучивания осадков со дна при волнении в ветреную погоду.
В РФ повышенной мутностью отличаются реки южных районов. Реки средней и северной территорий и многие реки Сибири имеют значительно меньшую мутность. Водам подземных источников, как правило, свойственна большая прозрачность.
Использование мутной вещы (без ее предварительного осветления) для некоторых категорий потребителей нежелательно или даже недопустимо. Так, вода для хозяйственно-питьевых нужд, не должна содержать более 1,5 мг/дм’ взвешенных веществ.
Многие производственные потребители могут использовать воду с содержанием взвешенных веществ более высоким по сравнению с допускаемым для питьевой воды. Однако для ряда производственных потребителей использование мутной воды нежелательно. Так, использование воды, содержащей механические примеси, для охлазвдения влечет за собой в некоторых случаях быстрое засорение охлаждающей аппаратуры. Допускаемое содержание взвеси в охлавдающей воде зависит от типа этой аппаратуры.
Цветность. Желтоватый, коричневый илн желто-зеленый оттенки воды природных источников объясняются главным образом присутствием в воде гумусовых и дубильных веществ, органических соединений, соединений железа, «цветением» водоемов.
Цветность свойственна воде рек, питающихся частично болотной водой, а иногда и воде водохранилищ. Измеряется цветность в градусах по так пазывае-
Имеющей " адЬТ0ВОЙ шкале путем сравнения исследуемой воды с водой, пР°водом не °НМую Цвс’Шость- Цветность питьевой воды, подаваемой водо — ^от также фокГ^ С1,свышагь 20 град. Для определения цветности исполь — ^лганосд воды° КалС®иметРы и спектрофотометры, измеряющие оптическую
Происходит яеа 64314 °° 3начительной цветностью на тех предприятиях, іде Цессе их изгото°С^ЄДСТВЄННОЄ сс*Ч5икосиовевис воды с фабрикатами в про — УХУДЩСНИ£Н<ИЯ ^НаПРИМеР’ в текстильной промышленности), может
”°сле хлорирования п ^ ОТМирания водорослей. Неприятный запах имеет вода Интенсивность зацахРИ ааличШ( в He® некоторых количеств остаточного хлора. Ры воды. Привкус со 3> КИК rrj3aBlffl0’ Увеличивается с повышением температу — н° миясрализовапичЯОНОБаТЫ^ и даже гоРЬко-ссміоноватьш часто имеют силь-
ИСТОЧНИКОВ.
■човдук, Пятибалльную °^еНКИ запаха и привкуса воды применяют обычно ус — чительной мере субъект КаЛ^’ ^’леА^ет> однако, отметить, что эта оценка в значимости ИсследовагеЛя ИВНа> ТЯК КЗК зависит от индивидуальной воелриим-
“ большинстве с
®ей задах и вкус воды ся* П*,И испаш>30вании воды для производственных це — 1сазыкать на присутс-ши™ П° °Є^Є несУ1цественны. Однако наличие их может
J Т’ьшадъ на прис ” несущественны. Однако наличие их может
ZMnepamypa в0^ т ® в ВОДе нежелательных примесей, течение года в ьесыия е’5а^аводЫп°вфхностных источников колеблется иулю до 25 °С, а итг» И^оких пРеДелах (для территории РФ — от близкой некие, имеют ПОЧТИ Ппгт/,11 ВЬ1Ше-*’ ®0да подземные, в особенности артези — Дая ПИтьевьк температуру в течение года.
с — 6 желательно использование воды температурой
°®Woe3Ha4e№^ ^ ”Ь^’1отТ*®ителсй температура веды источника имеет
" 110 Одлаждение или на тємпеРаїУРа весьма желательна для воды, иду-
Лк*°™тЮ ПЗРа’ Т8К МК 0Ш ПОЗВОПЯЄТ УМЄНЬ’
азот имеют значение для оиентсГ^*130’4’ угла*1сяоты. сероводород, метан и г, 0рсн придают воде пт an ЄЄ качества — Так, углекислота, сероводород, отношению к Металлам и к ^юде11енных Условиях коррозионные свойства И 6етонад-В табл. 3.2. показана растворимость га-
зов в воде при парциальном давлении (та часть общего давления в газовой смсси, которая обусловлена данным газом или паром) 0,1016 МПа в зависимости от температуры.
Сероводород в природных водах встречается органического (продукт распада органических соединений) и неорганического (растворение минеральных солей — серного колчедана, гипса и др.) происхождения. Присутствие сероводорода в поверхностных водах встречается в придонных слоях в незначительных количествах. В подземных водах оно наблюдается до нескольких десятков мг/дм Присутствие сероводорода в воде придает ей неприятный запах, способствует коррозии металла и может вызвать зарастание трубопроводов в результате интенсивного развитии серобактерий. Сероводород в зависимости ог pH воды может присутствовать в виде слабодиссоциированной кислоты — H2S, гидросульфидных — HS" или сульфидных ионов. Эти зависимости имеют важное значение при решении задачи удаления сероводорода из воды.
Кислород попадает в воду при се контакте с воздухом. Артезианские воды кислорода не содержат; а в поверхностных его концентрации довольно велики. В поверхностных водах содержание кислорода меньше теоретического за счет различных организмов, брожения, гниения органических остатков и т. п. Резкое снижение содержания кислорода в воде указывает на ее загрязнение.
Растворенный в воде кислород интенсифицирует коррозию металлов, поэтому в питательной воде теплоэнергетических установок содержание кислорода ограничено.
|
Таблица 3.2 РАСТВОРИМОСТЬ ГАЗОВ В ВОДЕ ПРИ РАЗЛИЧНЫХ ТЕМПЕРАТУРАХ
|
Азот в природные воды проникает из воздуха при разложении органических остатков, а также при восстановлении соединений азота денитрофици — рующими бактериями. Образующийся в воде в процессе гниения растений аммиак существенно влияет на технологию хлорирования воды.
Метан присутствует в природных ведах, используемых для водоснабжения, как правило, в незначительных количествах. Однако в болотных водах, где протекают процессы разложения клетчатки растительных остатков, а также в подземных водах газонсфтсносных районов содержание метана достигает 30мг/ дм и более.
Гидробиотпы, населяющие природные воды, в процессе жизнедеятельности влияют не только на состав окружающей водной среды, ио и на качество воды. Их подразделяют на:
• планктон — обитатели, пребывающие в толще воды от дна до поверхности; среди них различают плавающие, пассивно парящие и полуподводные (плейтон) организмы; взвешенные в воде остатки их органического и неорганического происхождения называют детритом;
• бентос — обитатели, находящиеся на дне водоема; среди них встречаются подвижно или неподвижно прикрепленные, свободно лежащие и ползающие по дну организмы, сверлящие дно, закапывающиеся;
• нейстон — организмы, населяющие поверхностную пленку воды и адаптировавшиеся к жизни в специфических условиях ее поверхностного натяжения;
• пагон — организмы (моллюски, ракообразные, коловратки и др.), пребывающие зимой в толще льда в состоянии анабиоза, оживающие весной и пребывающие среди бентоса или планктона.
На процессы формирования и самоочищения воды гидрофация оказывает значительное влияние, так как многие ее представители (зоопланктон и зообентос) используют растворенные органические вещества, некоторые животные- фильтраторы употребляют для питания бактерии, водоросли и т. п.
Гидрофлора водоемов определяется макро — и микрофитами. К первым относится высшая водная растительность, а ко вторым — водоросли (фитопланктон и фитобентое). В результате фотосинтеза увеличивается содержание растворенного в воде кислорода и снижается концентрация в ней свободной углекислоты, наблюдается снижение ВПК и содержания аммонийных солеА одновременно наблюдается возрастание нитритов, нитратов и окисляемостА — При отмирании и разложении миіфофитов вода обогащается органическими веществами, появляются пахнущие вещества, ухудшая органолептические показатели качества воды.
Микрофиты, подразделяемые на зеленые, синезеленые, эвгленовые, диато — мовые и др., не только поглощают углекислоту, кислород, а синезеленые азот (включая аммиак), но и продуцируют кислород. Наличие в колониях водорослей газовых вакуолей позволяет им находиться в верхних слоях воды. На глубине свыше 15 м интенсивного развития микрофитов не наблюдается из-за низкой температуры воды, отсутствия света, увеличения гидростатического давления и захоронения в донных отложениях биогенных элементов. Массовое развитие микрофитов в теплое время года, цветение воды, вносит в технологию улучшения ее качества, особенно для питьевых целей, значительные трудности, так как возникает необходимость в ее дезодорации и удалении планктона.
Бактерии и вирусы из чнела патогенных, т. е. паразитов, живущих па живом субстрате, развивающихся в воде, могут вызвать заболевания брюшным тифом, паратифом, дизентерией, бруцеллезом, инфекционным гепатитом, острым гастроэнтеритом, сибирской язвой, холерой, полиомиелитом, чуляреми — ей, конъюнктивитом и т. д.
Интересно отметить, что бациллы в неблагоприятных жизненных условиях образуют споры, которые могут сохраняться в жизнеспособном состоянии в течение сотен лет. При попадании в благоприятные условия споры прорастают, и бактерии начинают вновь размножаться.
Вирусы—мельчайшие живые существа размером 16-30 мкм, видимые только под электронным микроскопом. В отличие от бактерий они не имеют клетчатой структуры, а состоят из нуклеиновой кислоты, покрытой белковой оболочкой. Они имеют шаро — и кубообразную форму, а также форму прямых и изогнутых палочек. Вирусы являются внутриклеточными паразитами. Среди них встречаются бактериофаги, паразитирующие в клетках бактерий и вызывающие их разрушение и гибель.
Вирусы не размножаются на искусственных питательных средах. На холоде филирующиеся вирусы сохраняют свою активность на протяжении многих лег. При высушивании они приобретают стойкость к повышенным температурам. При температуре 900 °С вирусы пошбают. Некоторые энтеровирусы, в частности вирусы Коксаки, сохраняют инфекционные свойства при 4-6 °С до 11 дней. Энтеровирусы более устойчивы к действию ультрафиолетовых лучей и хлора, чем кишечная палочка. Следует отмстить, что коагуляция примесей воды снижает содержание вирусов в воде на 40 %, а кишечная палочка при этом удаляется на 85 %.
Между микробами водоемов существуют взаимоотношения симбиотического, нейтрального и антагонистического характера. Антагонисты бактерии различные грибки, выделяющие антибиотики (пенициллин, стрептомицин и др.) летально действуют на микробы, что способствует самоочищению водоемов.
Для каждого вида микробов существует оптимальное значение pH среды. Отклонение от этой величины вызывает коагуляцию коллоидов протоплазмы и нарушается каталитическая функция ферментов клетки. Для многих бакте — рий оптимальним, является pH воды 7,0, однако для нитркпіьк бактерий 4,7- 8,8, для нитратных — б,5-9,3, для серобактерии 1,0 4.0, для кишечной палочки — 4,4-7,8. Солнечный свет и ультрафиолетовые лучи оказывают летальное действие на микробы.
В связи с тем, что при биологическом анализе воды определение патогенных бактерий затруднено, бактериологические определении сводятся к нахождению общего числа бактерий в 1 мл воды, растущих при 37 °С’, и кишечной палочки бактерии коли. Наличие последней имеет индикаторные функции, т. е. свидетельствует о заірязнении воды выделениями людей и животных и т. п. Минимальный объем испытуемой воды (мл), приходящийся на одну кишечную палочку, называгот колититром, а количество кишечных палочек в 1 л воды колииндексом. Допускается колииндекс до 3, колититр не менее 300, а общее число бактерий в 1 мл — до 100.
Химические показатели качества йоды характеризуются ионами, составляющими основную часть природных вод; катионы — Са"’ Mg’’, К’, Na’ и в небольших количествах могут быть Fe2* и Fe5*, а также Al"; анионы НСО,, СО/, О, S042. Креме того, в природной воде присутствуют в том или ином количестве растворенные газы — 02, С02 и иногда SO,. В загрязненных водах помимо перечисленных находятся ионы N02~, NO,, S,. РО/ , а также в тех или иных концентрациях Fe2", Fe34, Al3′, Си2*, Zn2* и др.
Концентрации ионов в воде различных источников не одинаковы. Разнообразие химического состава и концентрации ионов в природных водах классифицируется у нас в стране по принципу, деления их по преобладающим анионам и катионам.
Все природные воды делятся по преобладающему аниону (по эквивалентам) на 3 класса; гидрокарбонатных (и карбонатных) (НСО, + СО,3 ), сульфатных (SOf) и хлоридных, (СГ) вод.
Поверхностные воды большей частью имеют гидрокарбонатно-калышевый состав, т. е. среди анионов в них преобладает анион НСО, , а среди катионов Са2 Появление ионаНС03′ в воде прямо или косвенно связано е деятельностью организмов (растворение С02 атмосферы, дыхание водных организмов, разложение мертвых остатков растений и животных, почвообразование на берегах и др.).
Следует иметь в виду, что химические элементы мигрируют в водах в виде ионов, недиссоциированных молекул или коллоидных частиц. По интенсивности миграции элементы делятся на очень подвижные {например, анионы серы, хлора и др.), подвижные и слабоподвижные катионы (Са2* Na2′ Mg2, К+, Р+ и др.).
Ниже приведены показатели качества воды.
Активист реакция (pH) или степень кислотности или щелочности хапакте — ризуемая количественно концентрацией водородных ионов Н’ ’
Большинство природных вод имеет величину pH в пределах 6,5-8,5. Величина pH поверхностных вод в связи с меньшим содержанием в них СО, обычно больше, чем величине pH подземных вод.
Кроме С02 на величину pH природных вод может влиять наличие органических гуминов и таниновых кислот (в болотных водах), а также кислые сточные воды.
Общая щелочность Що характеризуется наличием главным образом бикар — бонатных ионов (НС03~) и карбонатных ионов (СО~2). В сточных водах она может зависеть, кроме того, от присутствия гидроксильных ионов ОН’. Общая щелочность воды обуславливается широким диапазоном составляющих:
|
+ |
^,=[С0Г|’4[НС0^]+1[Н8!03]+4[Н2С03
2 2 2 (3.1)
+ |[HPOi’]+l[H2PO;]+|[HS-]+^[DH-]+^[NHj]
Суммарная концентрация кальция и магния определяет общую жесткость воды
Са2- Mg2+ з
Ш6МГ’ЭКВ/ЛМ-
Карбонарная жесткость воды Ж. зависит от совместного присутствия в воде кальция Са2 магния Mg2" и бикарбонатного иона НС03, т. е. бикарбонатов кальция —Са (НС03)2 и бикарбонатов магния — — Mg (НСОД.
При (Ca2*+Mg2+) мг-экв/дм3 > (НСО3-) мг-экв/дм3
НС03 /3 п
Ж г-мг-экв/дм, (3.2)
к 61,02
где НСО/ — содержание бикарбонатного иона в воде, мг/дм ; 61,02 эквивалентный вес бикарбонатного иона;
Некарбонатная жесткость воды Жак представляет собой разность между общей и карбонатной жесткостью:
ж =Ж — Ж мг/дм3. (3.3)
11К о к
Хлоридный ион (анион) СГ содержится почти во всех водах., отчасти это объясняется хорошей растворимостью хлористых солей. Содержание его изменяется в самых широких пределах.
Сульфатный ион S042~ распространен, как и ион СГ, хотя бы в малых количествах повсеместно; в сильно минерализованных водах его меньше, чем СГ, в слабоминерализованных — обычно больше.
Железо FeoSni в природных и оборотных водах, может быть в растворенном или нерастворенном состоянии
‘ + Fecn« +Fe (3.4)
взвешенное
нерастпорегіное
Общее солесодержание представляет собой сумму всех растворенных в воде веществ, которые определяют выпариванием профи дьтроваи н ой пробы, высушиванием при 105 °С полученного остатка (сухой остаток) до постоянного веса и его взвешиванием. Сухой остаток характеризует содержание минеральных и частично органических примесей (солей), температура кипения которых заметно превышает 105 °С, нелетучих е водяным паром и не разлагающихся при указанной температуре.
В воде источника, используемого для хозяйственно-питьевых целей, сухой остаток не должен превышать 1000 мг/дм3 и в особых случаях 1500 мг/дм.
Величина сухого остатка лимитируется также в воде, поступающей для питания паровых котлов и используемой в ряде производств (синтетического каучука, искусственного волокна, кинопленки и др.).
Свойства воды характеризуются в значительной мере углекислотным равновесием. От наличия в воде углекислоты и концентрации ее форм зависит стабильность воды, т. е. склонность к образованию карбонатных отложений или коррозии металла в системах водоснабжения, особенно при использовании воды в обороте в качестве теплоносителя (охладителя).
В природных водах углекислота может быть в трех видах: в виду «свободной» двуокиси углерода С02, находящейся в виде растворенного в воде газа и недиссоциированных молекул HjC03; в виде полусвязанной углекислоты (би — карбонатные ионы НCOf); в виде связанной углекислоты (карбонатные ионы С03г”). Часто углекислые соли составляют более половины общего количества солей, растворенных в природных водах. Обогащение этих вод углекислотой происходит вследствие химических и биохимических процессов, протекающих в грунтах и в воде при соприкосновении.
Бикарбоннтные и карбонатные ионы образуются при разложении двухосновной угопьиой кислоты, имеющей две ступени диссоциации:
Н2С03->Н++НС0;, (3-5)
hcoj~>h++hco| (3-6)
Этими уравнениями определяются количественные соотношения между различными формами углекислых соединений, присутствующих в воде.
Количественные соотношения между различными формами углекислоты определяется уравнениями диссоциации первой и второй степени. Константы диссоциации первой и второй степени if, и iCj зависят от концентрации водородных ионов, поэтому существование различных форм углекислоты определяется величиной pH.
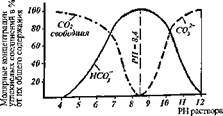
Из рис. 3.3 следует, что при pH 3,4-И-,0 вся находящаяся в воде углекислота представлена только углекислым газом С02. По мере повышения значения pH доля СО, уменьшается, а следовательно возрастает доля гидрокарбонатов. При pH = 8,3-5-8,4 практически вся углекислота находится в виде гидрокарбонатов (98 %), а на долю С02 и СО,’2 приходится менее 2 %.
При дальнейшем повышении значения pH (более 8,3-8,4) свободного углекислого газ в воде нет, а в растворе находятся только карбонаты. Экспериментально щелочность определяют титрованием соляной или серной кислотой последовательно с индикаторами фенолфталеином и метилоранжем.
Окисляемость воды — количество кислорода в мг/дм3, эквивалентное расходу окислителя, необходимого для окисления примесей в данном объеме обуславливается присутствием органических и некоторых легкоокисляющихся неорганических примесей, таких, как железо (II), сульфиты, сероводород и др. В зависимости от применяемого окислителя различают перманганатную и бих — роматнуго окисляемость. При этом окисляемость в 1 мгОУдм^ соответствует окисляемосги 0,253 мг/дм3 КМп04.
Резкое повышение окисляемосги воды свидетельствует о ее загрязнении сточными водами, поэтому по величине окисляемости природной воды можно судить о ее гигиенической характеристике. Для питьевой воды окисляемость не лимитируется, но она ограничивается для питательной воды котлов, так как вызывает ее вспенивание, ограничивается для охлаждающей воды из-за
|
рис. 3.3, Соотношение форм угольной кислоты в зависимости от pH раствора. |
возможного биообрастания труб и аппаратуры, лимитируется для воды, используемой при изготовлении синтетических волокон и пластмасс, и т. п.
Повышенное значение отношения цветности к окисляемосги указывает на преобладание в воде устойчивых гумусовых веществ болотного происхождения, а пониженное — о преобладании гумусовых веществ планктонного происхождения. Промежуточные значения этого отношения указывают на преобладание почвенного гумуса, Окисляемость воды после коагулирования, отстаивания и фильтрования снижается меньше, чем цветность.
Самоочищение водоемов сопровождается процессом потребления растворенного в воде кислорода. Различают химическую потребность в кислороде (ХЛК) и биологическую потребность в кислороде (БПК).
Содержание азотистых соединений. Наличие азотсодержащих соединений — нитратов (М03“), нитритов (NO2′) И аммонийных солей (NH4‘) —■ в воде поверхностных источников или в подземных водах может быть следствием загрязнения этих вод сточными водами. При этом наличие аммонийных соединений указывает на свежее загрязнение, а наличие нитритов — на относительно недавнее загрязнение. Содержание в воде нитратов может указывав) на давнее (уже ликвидированное) загрязнение источника сточными водами.
Однако нитраты, обнаруженные в водах источника, могут быть и неорганического происхождения и не свидетельствовать о загрязнении источника-^
Б питьевой воде допускается содержание нитратов (по N) не более 10 мг/дм —